Osteosarkom (Kurzinformation)
Osteosarkome sind seltene, bösartige Knochentumoren. In diesem Text erhalten Sie Informationen zu Krankheitsbild und möglichen Krankheitsverläufen, Ursachen und Symptomen, zu Diagnostik, Therapieplanung und Behandlung sowie zur Prognose der Erkrankung.
Autor: Maria Yiallouros, Dr. med. habil. Gesche Tallen, erstellt am: 12.02.2009, Redaktion: Maria Yiallouros, Freigabe: Prof. Dr. med. Stefan Bielack, Dr. med. Dorothee Carrle, Dr. med. Stefanie Hecker-Nolting, Zuletzt geändert: 18.02.2020 doi:10.1591/poh.patinfo.osteosarkom.kurz.20101215
Inhaltsverzeichnis
Krankheitsbild
Osteosarkome sind seltene, bösartige Knochentumoren. Sie gehören zu den soliden Tumoren und entstehen durch die Entartung von Zellen, die normalerweise Knochen bilden. Da sie direkt vom Knochengewebe ausgehen, werden sie auch als primäre Knochentumoren bezeichnet. Damit werden sie von Absiedlungen (Metastasen) bösartiger Tumoren abgegrenzt, die in einem anderen Organ entstanden sind. Die meisten Osteosarkome wachsen und streuen sehr schnell, sodass die Erkrankung ohne eine wirksame Behandlung tödlich verläuft.
Häufigkeit
Osteosarkome sind die häufigsten bösartigen Knochentumoren im Kindes- und Jugendalter. Nach Angaben des Deutschen Kinderkrebsregisters in Mainz erkranken in Deutschland derzeit etwa 2 bis 3 von 1.000.000 (das heißt insgesamt etwa 40) Kindern und Jugendlichen unter 15 Jahren jedes Jahr neu an einem Osteosarkom. Die Erkrankung macht damit etwa 2 % aller Krebserkrankungen in dieser Altersgruppe aus. Allerdings treten Osteosarkome meist im zweiten Lebensjahrzehnt während der pubertären Wachstumsphase auf, und hier mit zunehmendem Alter gehäuft. Bei Jugendlichen im Alter zwischen 15 und 19 Jahren machen Osteosarkome daher einen größeren Anteil an den bösartigen Erkrankungen des Kindes- und Jugendalters aus (über 5 %). Der Häufigkeitsgipfel liegt bei Mädchen bei 14 Jahren, bei Jungen bei 16 Jahren. Männliche Patienten sind häufiger betroffen als weibliche. Bei Kleinkindern treten Osteosarkome extrem selten auf.
Lage und Ausbreitung
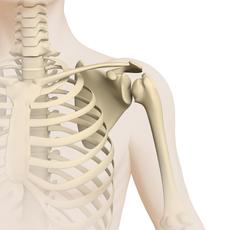
Osteosarkome entstehen überwiegend in den langen Röhrenknochen der Arme und Beine (zum Beispiel in Oberschenkel, Schienbein und Oberarm) und dort vor allem gelenknah im Bereich der so genannten Metaphysen. In diesen Knochenabschnitten (sie beinhalten die so genannte Wachstumsfuge) findet während des Wachstums, ganz besonders während des Wachstumsschubes in der Pubertät, das Längenwachstum der Knochen statt.
Über 50 % aller Osteosarkome liegen im Bereich (also oberhalb oder unterhalb) des Kniegelenks. Prinzipiell können Osteosarkome jedoch in jedem Knochen auftreten. Der Tumor kann sich dabei ausschließlich auf den Knochen und das Knochenmark erstrecken, meist befällt er aber auch mehr oder weniger stark das benachbarte Weichteilgewebe, also zum Beispiel Binde-, Fett-, Muskelgewebe und/oder Gewebe peripherer Nerven. In selteneren Fällen entsteht ein Osteosarkom nicht im Knochen, sondern an der Knochenoberfläche (periosteal oder parosteal) oder außerhalb der Knochen (extraossär).
Bei etwa 10 bis 20 % der Kinder und Jugendlichen findet man zum Zeitpunkt der Diagnose sichtbare Metastasen. Aber auch bei allen anderen Patienten mit einem hochgradig bösartigen Osteosarkom ist immer davon auszugehen, dass der Tumor bereits über den Blut- und Lymphweg kleinste Tochtergeschwülste – so genannte Mikrometastasen – in anderen Organen gebildet hat. Sie können lediglich aufgrund ihrer geringen Größe noch nicht nachgewiesen werden. Am häufigsten metastasieren Osteosarkome über die Blutbahn in die Lunge (zu etwa 70 %), seltener in Knochen und andere Organe. Metastasen können auch in Lunge und Knochen gleichzeitig vorliegen. Eine Metastasierung über den Lymphweg mit Bildung von Lymphknotenmetastasen ist extrem selten.
Nur sehr selten (bei weniger als 5 % der Patienten) tritt der Tumor von Anfang an in verschiedenen Knochen auf. Man spricht dann von einer multilokulären Erkrankung.
Feingewebliche Eigenschaften und Tumortypen
Ein charakteristisches Merkmal der Osteosarkome ist, dass die Tumorzellen – anders als gesunde knochenbildende Zellen – unreifen Knochen (Osteoid) produzieren. Das heißt, sie bilden zwar Knochengrundsubstanz, aber keinen Kalk. Allein daran lässt sich ein Osteosarkom von anderen Knochentumoren abgrenzen.
Darüber hinaus sind die feingeweblichen Eigenschaften eines Osteosarkoms allerdings sehr vielfältig und damit zum Teil auch das biologische Verhalten der Tumoren. Die meisten Osteosarkome, die bei Kindern und Jugendlichen auftreten (über 90 %), sind sehr bösartig (hochmaligne), da sie rasch wachsen und sehr schnell metastasieren. Die Fachleute sprechen auch von Grad 3- (G3-)Tumoren. Nur wenige Osteosarkomformen können als geringgradig oder mittelgradig (intermediär) bösartig bezeichnet werden (so genannte G1- beziehungsweise G2-Tumoren).
Die Weltgesundheitsorganisation (englisch: World Health Organisation, WHO) teilt Osteosarkome anhand ihrer feingeweblichen Eigenschaften in folgende Typen ein:
- Parosteales (paraossales) Osteosarkom (in der Regel wenig bösartig, G1)
- Niedrigmalignes zentrales (intramedulläres) Osteosarkom (wenig bösartig, G1)
- Periostales Osteosarkom (mittelgradig bösartig, G2)
- Konventionelles Osteosarkom (sehr bösartig, G3)
- Teleangiektatisches Osteosarkom (sehr bösartig, G3)
- Kleinzelliges Osteosarkom (sehr bösartig, G3)
- Sekundäres Osteosarkom (in der Regel sehr bösartig, G3)
- Hochmalignes Oberflächenosteosarkom (sehr bösartig, G3)
Am häufigsten sind die hochmalignen konventionellen Osteosarkome. Sie machen etwa 80 bis 90 % aller Osteosarkome aus und werden nach der WHO-Klassifikation weiter unterteilt. Alle anderen Osteosarkomformen kommen selten vor (zu jeweils weniger als 5 %). Der Grad der Bösartigkeit wird bei der Behandlungsplanung mit berücksichtigt.
Ursachen
Die Ursachen für die Entstehung eines Osteosarkoms sind im Einzelnen noch nicht geklärt. In Erwägung gezogen werden genetische, epigenetische und wachstumsbedingte Ursachen. Häufig findet man in den Tumorzellen Veränderungen in der Erbinformation, zum Beispiel in so genannten Tumorsuppressorgenen (wie dem Retinoblastomgen oder dem TP53-Gen), deren Aufgabe es normalerweise ist, die Tumorentstehung zu verhindern. Generell sind genetische Defekte in Osteosarkomzellen sehr komplex und gehen mit Störungen der Zellzykluskontrolle, der Zellkommunikation oder der Reifung der knochenbildenden Zellen einher. Da Osteosarkome vermehrt während des Pubertätswachstums auftreten, nimmt man an, dass die mit der Pubertät einhergehenden Wachstumssignale bei der Entstehung und beim Wachstum (Progression) von Osteosarkomen eine Rolle spielen können.
Darüber hinaus sind verschiedene Faktoren bekannt, die das Risiko für die Entstehung eines Osteosarkoms erhöhten können. Dazu gehören radioaktive Strahlung, wie sie zum Beispiel im Rahmen einer Strahlentherapie verabreicht wird, sowie bestimmte Zellgifte, die bei der chemotherapeutischen Behandlung mancher Krebserkrankungen eingesetzt werden (Zytostatika, insbesondere Alkylantien). Sie können das Erbmaterial knochenbildender Zellen schädigen und so die Entstehung eines Knochentumors mit auslösen.
Ein erhöhtes Risiko haben außerdem Kinder und Jugendliche mit einem so genannten Krebsprädispositionssyndrom, einem genetisch bedingten Krankheitsbild, das mit einer erblichen Veranlagung für Tumoren einhergeht. Krebsprädispositionssyndrome, die bei der Entstehung eines Osteosarkoms eine Rolle spielen, sind zum Beispiel das erbliche (meist beidseitige) Retinoblastom, das Li-Fraumeni-Syndrom oder das Bloom-Syndrom. Auch verschiedene chronische Knochenerkrankungen, wie zum Beispiel die Paget-Krankheit (Morbus Paget), sind mit einem erhöhten Osteosarkomrisiko verbunden.
Für die Mehrheit der Patienten mit einem Osteosarkom (90 %) lassen sich jedoch keine der oben erwähnten Risikofaktoren nachweisen.
Krankheitszeichen
Die häufigsten Beschwerden, die durch ein Osteosarkom verursacht werden, sind Schmerzen und/oder eine (zunehmende) Schwellung in der vom Tumor betroffenen Region.
Die Schmerzen können unregelmäßig auftreten und als belastungsabhängig empfunden werden, oft treten sie aber auch belastungsunabhängig auf. Etwa ein Viertel der Patienten klagt beispielsweise über Schmerzen in der Nacht. Zu den Schmerzen kann – mit zunehmendem Tumorwachstum – eine sicht- und/oder tastbare, eventuell gerötete und überwärmte Schwellung in der betreffenden Knochenregion (häufig im Bereich des Kniegelenks) hinzukommen. Sie kann mit einer Bewegungseinschränkung verbunden sein und wird anfangs häufig als Folge einer Sportverletzung oder Knochenentzündung fehlgedeutet. Manchmal führt an dieser Stelle bereits eine geringfügige Verletzung zum Knochenbruch (pathologische Fraktur). Bei einigen Patienten (circa 5 bis 10 %) stellt der Knochenbruch das erste Symptom dar. Die Beschwerden werden durch das Wachstum des Tumors innerhalb des schmerzempfindlichen Knochens und des umgebenden Weichteilgewebes ausgelöst.
Bei fortgeschrittener Erkrankung können Allgemeinsymptome wie Fieber, Gewichtsabnahme, Leistungsschwäche und/oder Müdigkeit hinzukommen. Von den ersten Symptomen bis zur endgültigen Diagnose der Erkrankung können wenige Wochen bis einige Monate vergehen.
Gut zu wissen: Kinder und Jugendliche mit Beschwerden, wie sie hier beschrieben sind, haben selbstverständlich nicht immer ein Osteosarkom oder einen anderen bösartigen Knochentumor. Dennoch ist es ratsam, jede Form von Knochenschmerzen im Kindes- und Jugendalter sorgfältig durch einen erfahrenen Kinderarzt abklären zu lassen, um eine bösartige Erkrankung auszuschließen.
Diagnose
Findet der (Kinder-)Arzt durch Krankheitsgeschichte (Anamnese) und körperliche Untersuchung Hinweise auf einen bösartigen Knochentumor, wird er den Patienten in ein Krankenhaus überweisen, das auf Krebserkrankungen bei Kindern und Jugendlichen spezialisiert ist (Klinik für pädiatrische Onkologie/Hämatologie). Denn bei Verdacht auf einen solchen Tumor sind umfangreiche Untersuchungen und die Zusammenarbeit von Spezialisten unterschiedlicher Fachrichtungen notwendig, um festzustellen, ob tatsächlich ein bösartiger Knochentumor vorliegt und, wenn ja, um welche Form des Tumors es sich handelt und wie weit sich die Erkrankung im Körper ausgebreitet hat. Die Klärung dieser Fragen ist Voraussetzung für eine optimale Behandlung und Prognose des Patienten.
Bildgebende Untersuchungen zum Tumornachweis
Der Verdacht auf einen bösartigen Knochentumor kann – nach erneuter sorgfältiger Anamnese und klinischer Untersuchung – meist schon anhand typischer Befunde im Röntgenbild [Röntgenuntersuchung] erhärtet werden. Mit Hilfe zusätzlicher bildgebender Verfahren wie der Magnetresonanztomographie (MRT) und/oder der Computertomographie (CT) lassen sich die genaue Lage und Größe des Tumors sowie seine Abgrenzung zu Nachbarstrukturen (wie Blutgefäßen, Muskel-, Nerven- und Sehnengewebe oder Gelenkkapseln) sehr gut darstellen. Auch nahe gelegene Metastasen – so genannte Skip-Metastasen – sind mit diesen Methoden gut sichtbar. Die MRT ist bei der Bestimmung betroffener Weichteil- und Knochenmarkanteile der CT überlegen, so dass dieses Verfahren neben der Röntgenübersichtsaufnahme des betroffenen Knochens bevorzugt bei der Erstdiagnose des Tumors eingesetzt wird.
Entnahme und Untersuchung von Tumorgewebe
Um die Diagnose eines Osteosarkoms endgültig zu sichern, muss in jedem Fall eine Gewebeprobe entnommen werden. Die Gewebeentnahme (Biopsie) sollte von Ärzten durchgeführt werden, die auch auf die Operation von Sarkomen spezialisiert sind. Damit wird sichergestellt, dass der für die Biopsie gewählte Zugang später nicht zu Problemen bei der weiteren Behandlung führt. Eine ungünstig geplante Biopsie kann im schlimmsten Fall dazu führen, dass eine spätere Operation sehr viel größer ausfallen muss als eigentlich notwendig wäre. Auch kann ein nicht optimales Vorgehen bei der Gewebeentnahme mit einem erhöhten Risiko für einen Krankheitsrückfall einhergehen.
Die entnommenen Gewebeproben werden anschließend von mehreren Spezialisten sowohl feingeweblich (histologisch) als auch immunhistochemisch und molekulargenetisch untersucht. Die Untersuchungen dienen der Feststellung, ob tatsächlich ein Osteosarkom vorliegt und wenn ja, um welche Unterform es sich handelt.
Untersuchungen zur Metastasensuche
Wenn die Diagnose „Osteosarkom“ feststeht, erfolgen weitere Untersuchungen zur Klärung der Krankheitsausbreitung. Auch hier spielen bildgebende Verfahren eine maßgebende Rolle. Da Osteosarkome vorwiegend in die Lunge metastasieren, sind eine Röntgenuntersuchung und eine Computertomographie der Lunge unverzichtbar. Zur Ortung eventueller Fernmetastasen in die Knochen erfolgt eine Skelett-Szintigraphie mit schwach radioaktiv markiertem Technetium (99m-Tc). Im Rahmen von Studien wird untersucht, ob andere bildgebende Verfahren, wie beispielsweise die Positronen-Emissions-Tomographie (PET) in Kombination mit einer Computertomographie (PET-CT) oder eine Ganzkörper-Magnetresonanztomographie (MRT), die Skelett-Szintigraphie gleichwertig ersetzen können.
Behandlungsvorbereitende Untersuchungen
Vor Beginn der Behandlung kommen weitere Untersuchungen hinzu, um den Zustand und die Funktion bestimmter Organe zu überprüfen. Dazu gehören insbesondere eine Überprüfung der Herzfunktion (Elektrokardiographie [EKG] und Echokardiographie), der Hörfunktion (Audiometrie) und der Nieren- und Lungenfunktion sowie verschiedene Blutuntersuchungen. Veränderungen, die möglicherweise im Laufe der Therapie auftreten, können aufgrund solcher Ausgangsbefunde besser beurteilt und bei der Behandlung entsprechend berücksichtigt werden.
Therapieplanung
Nachdem die Diagnose feststeht, erfolgt die Therapieplanung. Um eine möglichst individuelle, auf den Patienten zugeschnittene (risikoadaptierte) Behandlung durchführen zu können, berücksichtigt das Behandlungsteam bestimmte Faktoren, die die Prognose des Patienten beeinflussen (so genannte Risiko- oder Prognosefaktoren).
Wichtige Prognosefaktoren bei Patienten mit einem Osteosarkom sind zum einen die Art, Lage und Ausdehnung des Tumors und eventuell vorhandener Metastasen, die anhand der beschriebenen Diagnoseverfahren ermittelt werden. Darüber hinaus spielen aber auch das Ausmaß der operativen Tumor-/Metastasenentfernung (unvollständig oder vollständig) sowie das Ansprechen der Erkrankung auf die Chemotherapie eine sehr wichtige Rolle. All diese Faktoren fließen in die Behandlungsplanung ein mit dem Ziel, für jeden Patienten das jeweils bestmögliche Behandlungsergebnis zu erreichen.
Therapie
Die Behandlung eines Patienten mit Osteosarkom muss in einer kinderonkologischen Behandlungseinrichtung erfolgen. Dort ist das hoch qualifizierte Fachpersonal (Ärzte, Fachpflegekräfte) auf die Behandlung krebskranker Kinder spezialisiert und mit den modernsten Therapieverfahren vertraut. Die Ärzte dieser Klinikabteilungen stehen in fachorientierten Arbeitsgruppen in ständiger, enger Verbindung miteinander und behandeln ihre Patienten nach gemeinsam entwickelten und stetig weiter verbesserten Therapieplänen. Ziel der Behandlung ist, eine Heilung des Patienten zu erreichen und dabei das Risiko therapiebegleitender Nebenwirkungen und Spätfolgen so gering wie möglich zu halten.
Behandlungsmethoden
Bei Patienten mit einem hochgradig bösartigen Osteosarkom besteht die Behandlung prinzipiell aus einer Operation (lokale Therapie) und einer Chemotherapie. Nur bei den seltenen Patienten mit einem geringgradig bösartigen Osteosarkom kann unter bestimmten Voraussetzungen eine Operation ausreichend sein. Die Strahlentherapie spielt eine untergeordnete Rolle. Sie wird nur in Erwägung gezogen, wenn eine Operation nicht umfassend möglich ist. Die Gesamtdauer der Therapie beträgt etwa neun bis zwölf Monate.
Die Operation dient der Entfernung des Tumors. Bei der Chemotherapie werden Medikamente (so genannte Zytostatika) eingesetzt, die das das Zellwachstum hemmen und so zur Vernichtung des Tumors beitragen. Eine eventuell erforderliche Strahlentherapie erfolgt durch den Einsatz energiereicher Strahlen, die von außen durch die Haut auf die betroffene Region eingestrahlt werden. Sie verursachen Schäden im Erbgut der Tumorzellen und führen dadurch zu deren Absterben.
Da die Behandlung eines Osteosarkoms mit akuten Nebenwirkungen einhergehen kann, erfolgen während der Behandlung unterstützende Therapiemaßnahmen (Supportivtherapie), die der Vorbeugung und/oder Behandlung dieser Begleiteffekte dienen. Hier finden Sie Informationen zur Supportivtherapie sowie hilfreiche Empfehlungen für zu Hause.
Behandlungsablauf
International gilt für Patienten mit einem hochgradig bösartigen Osteosarkom derzeit der folgende Therapieablauf als Standard: Im ersten Schritt erfolgt eine präoperative (neoadjuvante) Chemotherapie über eine Gesamtdauer von zwei bis drei Monaten. Es folgt eine Operation (in bestimmten Fällen gefolgt von einer Strahlentherapie) und im Anschluss an die Operation eine weitere (adjuvante) Chemotherapie über sechs Monate. Die verschiedenen Therapiephasen werden im Anschluss genauer erläutert.
Chemotherapiephase vor der Operation
In der Regel wird bei Patienten mit einem hochmalignen Osteosarkom die Behandlung mit einer etwa zehnwöchigen Chemotherapie (Induktions-Chemotherapie) eingeleitet. Das Ziel dieser präoperativen Chemotherapie ist, den Primärtumor und eventuell vorhandene Metastasen zu verkleinern und abzutöten und auf diese Weise die nachfolgende Operation schonender und sicherer und damit so effektiv wie möglich zu machen. Darüber hinaus dient die Chemotherapie der Bekämpfung kleinster, noch nicht sichtbarer Tochterabsiedelungen (Mikrometastasen) und soll verhindern, dass der Tumor weiter streut.
Um möglichst alle bösartigen Tumorzellen zu vernichten, wird – im Rahmen einer so genannten Polychemotherapie – eine Kombination verschiedener zellwachstumshemmender Medikamente (Zytostatika) eingesetzt, die sich bei der Bekämpfung von Osteosarkomen als besonders wirkungsvoll erwiesen haben. Hierzu gehören die Medikamente Methotrexat (hochdosiert, HD-MTX), Adriamycin (= Doxorubicin) und Cisplatin (kurz "MAP" genannt). Die Zytostatika werden in mehreren mehrtägigen Chemotherapiezyklen verabreicht (insgesamt zwei Zyklen Cisplatin/Doxorubicin und vier Zyklen Methotrexat). In dieser Zeit wird der Patient in die Klinik aufgenommen. In den dazwischen liegenden Therapiepausen kann der Patient in der Regel zu Hause sein; nur wenn schwere Nebenwirkungen auftreten, ist eine erneute stationäre Aufnahme erforderlich.
Lokaltherapie
Die Lokaltherapie der Wahl ist die Operation. Nur bei Tumoren, die aufgrund ihrer Lage oder Ausdehnung – nach Ausschöpfung der chirurgischen Optionen – nicht oder nur teilweise operabel sind, kann eine (zusätzliche) Strahlentherapie in Frage kommen.
Operation
Im Anschluss an die Chemotherapie erfolgt, nach einer Erholungsphase, die möglichst vollständige operative Entfernung des Tumors. Sowohl mittels Bildgebung sichtbare (makroskopische) wie auch mikroskopisch kleine Tumoranteile sollen im Rahmen der Operation erfasst werden, denn eine komplette Tumorentfernung ist für die weiteren Heilungschancen von großer Bedeutung. Das bedeutet, dass der Tumor unverletzt und allseits umhüllt von gesundem Gewebe mitsamt der Biopsienarbe und des Biopsie-Zugangskanals entfernt werden muss.
Auch eventuell vorhandene Metastasen müssen operiert werden, damit eine Heilungschance besteht. Dank der großen Fortschritte im Bereich der Gliedmaßen-erhaltenden Operationstechniken kann die Tumorentfernung heute oft durchgeführt werden, ohne dass eine Amputation notwendig ist. Zur Rekonstruktion der betroffenen Gliedmaßen stehen verschiedene Verfahren zur Verfügung, die sich unter anderem nach der Lage des Tumors und dem Ausmaß des chirurgischen Eingriffes richten.
Nach der Operation untersucht der Pathologe das Osteosarkom um festzustellen, wie gut die Erkrankung auf die vorangegangene Chemotherapie angesprochen hat. Dies wird am Anteil der noch verbliebenen lebenden Tumorzellen gemessen. Liegt der Anteil unter 10 %, so spricht man von einem guten Tumoransprechen. Bei etwa der Hälfte der Patienten mit einem Osteosarkom wird dies erreicht.
Strahlentherapie
Können Tumor und/oder Metastasen nicht oder nicht vollständig entfernt werden, kann in bestimmten Situationen zusätzlich (oder anstelle der Operation) eine Bestrahlung der Tumorregion erwogen werden. Das Für und Wider einer Strahlentherapie muss im Einzelfall interdisziplinär diskutiert und entschieden werden. In geeigneten Fällen können moderne Bestrahlungsverfahren wie die so genannte Intensitätsmodulierte Radiotherapie (IMRT) oder auch eine Protonen- oder Schwerionenbestrahlung zur Anwendung kommen. Die Durchführbarkeit der Schwerionenbestrahlung bei Kindern und Jugendlichen mit nicht operablen Tumoren wird derzeit im Rahmen einer klinischen Studie überprüft .
Chemotherapiephase nach der Operation
Nach der Operation wird die Chemotherapie mit den oben genannten Zytostatika Methotrexat, Adriamycin und Cisplatin (MAP) fortgesetzt (postoperative Chemotherapie). Die Behandlung besteht aus zwölf Zyklen (insgesamt zwei Zyklen Cisplatin/Doxorubicin, zwei Zyklen Doxorubicin und acht Zyklen Methotrexat) und dauert – einschließlich der Therapiepausen – circa sechs bis sieben Monate.
Behandlung bei Krankheitsrückfall
Etwa 20 bis 40 % der Patienten mit Osteosarkom erleiden einen Krankheitsrückfall (Rezidiv). Ebenso wie beim Ersttumor ist auch im Rezidivfall eine vollständige chirurgische Entfernung aller Tumorherde erforderlich, damit eine Heilungschance besteht. Die weitere Behandlung richtet sich unter anderem nach der Lage des Tumors und dem Zeitpunkt des Rückfalls (frühes oder spätes Rezidiv).
Bei vereinzelt auftretenden Lungenmetastasen, insbesondere wenn diese später als zwei bis drei Jahre nach der Erstdiagnose des Osteosarkoms auftreten, kann unter Umständen eine alleinige Operation die Krankheit langfristig zurückdrängen. In allen anderen Fällen ist im Anschluss an die Operation eine erneute Chemotherapie notwendig. Zum Einsatz kommen zum Beispiel die Medikamente Carboplatin und Etoposid oder Ifosfamid. In Situationen, in denen nur noch eine Palliativtherapie möglich ist, kann eine Bestrahlung in Frage kommen. Insgesamt ist die Prognose für Patienten mit Krankheitsrückfall ungünstig.
Therapieoptimierungsstudien / Register
In den großen Behandlungszentren der Welt werden Kinder und Jugendliche mit einem Osteosarkom nach standardisierten Behandlungsprotokollen behandelt. Sie alle haben zum Ziel, die Langzeitüberlebensraten der Patienten zu verbessern und gleichzeitig therapiebedingte Spätfolgen so gering wie möglich zu halten. Die Behandlung nach solchen Therapieprotokollen erfolgt in aller Regel im Rahmen von Therapieoptimierungsstudien oder Registern.
Therapieoptimierungsstudien sind kontrollierte klinische Studien, die darauf abzielen, erkrankte Patienten nach dem jeweils aktuellsten Wissensstand zu behandeln und gleichzeitig die Behandlungsmöglichkeiten zu verbessern und weiterzuentwickeln. Patienten, die an keiner Studie teilnehmen, entweder, weil zum Zeitpunkt ihrer Erkrankung keine Studie verfügbar ist oder weil sie die Einschlusskriterien einer bestehenden Studie nicht erfüllen, werden oft in einem so genannten Register dokumentiert. Diese dienen zunächst dazu, die Therapie der Patienten wissenschaftlich zu begleiten. Zur Sicherung der optimalen Behandlung verfasst darüber hinaus die jeweilige Studiengruppe in der Regel detaillierte Empfehlungen und berät die behandelnden Ärzte bei der Auswahl der optimalen Therapie für den einzelnen Patienten.
In Deutschland war für Osteosarkom-Patienten bis Juni 2011 eine Aufnahme in die internationale Therapieoptimierungsstudie EURAMOS 1 möglich. Die Studie wurde von der Cooperativen Osteosarkom-Studiengruppe COSS der deutschen Fachgesellschaft für Krebserkrankungen im Kindes- und Jugendalter (Gesellschaft für Pädiatrische Onkologie und Hämatologie, GPOH) gemeinsam mit drei weiteren, weltweit renommierten Osteosarkom-Gruppen durchgeführt. Zahlreiche Kinderkliniken und Behandlungseinrichtungen in ganz Deutschland und anderen europäischen sowie nordamerikanischen Ländern waren daran beteiligt. Ergebnisse zur Studie finden Sie hier.
Seit die EURAMOS-Studie für die Patienten-Neuaufnahme geschlossen ist, werden alle Patienten in einem Register (COSS-Register) erfasst, bis die Nachfolgestudie eröffnet werden kann. Die deutsche Studien- und Registerzentrale befindet sich an der Klinik für Kinder- und Jugendmedizin des Olgahospitals in Stuttgart (Studienleitung: Professor Dr. med. Stefan Bielack).
Im Rahmen des Registers erfolgen keine Vorgaben bezüglich diagnostischer und therapeutischer Vorgehensweise. Die Studienzentrale empfiehlt jedoch für alle Patienten, die nicht an einer Studie teilnehmen, die bisherige Standardbehandlung (MAP-Chemotherapie vor und nach Operation, siehe Abschnitt „Therapie“). Die Empfehlungen erstrecken sich auch auf Diagnostik, Supportivtherapie und Nachsorge. Der Einschluss von Patienten in eventuell verfügbare klinische Studien wird befürwortet. Ihr Behandlungsteam wird Sie über Möglichkeiten informieren.
Prognose
Die Prognose von Kindern und Jugendlichen mit einem hochgradig bösartigen Osteosarkom hängt von verschiedenen Faktoren ab. Entscheidend sind insbesondere die Art und Lage des Tumors, seine Ausdehnung zum Zeitpunkt der Diagnose, das Ansprechen der Erkrankung auf die vor der Operation erfolgte Chemotherapie sowie das Ausmaß der Tumor- und gegebenenfalls Metastasenentfernung.
In den letzten vier Jahrzehnten haben sich dank der großen Therapiefortschritte im Rahmen der Therapieoptimierungsstudien die Überlebensaussichten von Patienten mit hochmalignem Osteosarkom deutlich verbessert.
Durch die Kombination verschiedener Therapiemethoden und ganz besonders durch die Einführung intensiver, standardisierter Kombinations-Chemotherapien können heute langfristige Gesamt-Überlebensraten von etwa 70 % erreicht werden. Voraussetzung für eine günstige Prognose ist in der Regel, dass der Tumor lokal begrenzt ist, vollständig entfernt werden kann und die Erkrankung gut auf die Chemotherapie anspricht.
Die günstigsten Aussichten haben Patienten mit nicht-metastasierten Tumoren der Arme oder Beine: Die Heilungsaussichten können bei über 70 % liegen. Dabei spielt insbesondere das Ansprechen der Erkrankung auf die Chemotherapie eine entscheidende Rolle: Patienten mit gutem Ansprechen (das heißt, mit weniger als 10 % lebenden Tumorzellen nach der Chemotherapie) haben eine deutlich bessere Prognose als solche mit schlechtem Ansprechen. Bei Letzteren ist die Gefahr eines Krankheitsrückfalles hoch; die Wahrscheinlichkeit für ein Rezidiv beträgt über 50 %.
Patienten mit einem Tumor des Rumpfes oder mit großen Tumoren, die meist aufgrund ihrer Lage beziehungsweise Ausdehnung nicht vollständig entfernt werden können, haben eine ungünstigere Prognose als Patienten mit einem (in der Regel besser operablen) Extremitätentumor oder einem kleinen Tumor. Sind zum Zeitpunkt der Diagnose Metastasen vorhanden, so ist vor allem deren Lage und Operabilität entscheidend. Patienten mit einzelnen, operablen Lungenmetastasen haben eine bessere Überlebenschance als Patienten mit Knochentumoren oder multilokulärem Osteosarkom. Bei Patienten, die einen Krankheitsrückfall erleiden, ist die Prognose (mit einer Überlebenswahrscheinlichkeit von 20 bis 25 %) in der Regel besonders ungünstig. Eine Heilung ist aber auch bei einer Rezidiverkrankung noch möglich, wenn der Tumor komplett entfernt werden kann.
Anmerkung: Bei den genannten Überlebensraten handelt es sich um statistische Größen. Sie stellen nur für die Gesamtheit der an einem Osteosarkom erkrankten Patienten eine wichtige und zutreffende Aussage dar. Ob der einzelne Patient geheilt werden kann oder nicht, lässt sich aus der Statistik nicht vorhersagen. Der Begriff Heilung muss hier vor allem als „Tumorfreiheit“ verstanden werden. Denn auch wenn die heute verfügbaren Therapiemethoden zu langfristiger Tumorfreiheit führen können, so sind sie doch meist auch mit unerwünschten Nebenwirkungen und Spätschäden verbunden, die in der Regel eine intensive Rehabilitation und eine langfristige orthopädische Betreuung erforderlich machen.
Literaturliste 
- Kaatsch P, Grabow D, Spix C: German Childhood Cancer Registry - Anual Report 2018 (1980-2017). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz 2019 [URI: www.kinderkrebsregister.de]
- Smeland S, Bielack SS, Whelan J, Bernstein M, Hogendoorn P, Krailo MD, Gorlick R, Janeway KA, Ingleby FC, Anninga J, Antal I, Arndt C, Brown KLB, Butterfass-Bahloul T, Calaminus G, Capra M, Dhooge C, Eriksson M, Flanagan AM, Friedel G, Gebhardt MC, Gelderblom H, Goldsby R, Grier HE, Grimer R, Hawkins DS, Hecker-Nolting S, Sundby Hall K, Isakoff MS, Jovic G, Kühne T, Kager L, von Kalle T, Kabickova E, Lang S, Lau CC, Leavey PJ, Lessnick SL, Mascarenhas L, Mayer-Steinacker R, Meyers PA, Nagarajan R, Randall RL, Reichardt P, Renard M, Rechnitzer C, Schwartz CL, Strauss S, Teot L, Timmermann B, Sydes MR, Marina N: Survival and prognosis with osteosarcoma: outcomes in more than 2000 patients in the EURAMOS-1 (European and American Osteosarcoma Study) cohort. European journal of cancer 2019, 109: 36 [PMID: 30685685]
- Kager L, Bielack S: Osteosarkome. in: Niemeyer C, Eggert A (Hrsg.): Pädiatrische Hämatologie und Onkologie, Springer-Verlag GmbH Deutschland 2. vollständig überarbeitete Auflage 2018, 509 [ISBN: 978-3-662-43685-1]
- Casali PG, Bielack S, Abecassis N, Aro HT, Bauer S, Biagini R, Bonvalot S, Boukovinas I, Bovee JVMG, Brennan B, Brodowicz T, Broto JM, Brugières L, Buonadonna A, De Álava E, Dei Tos AP, Del Muro XG, Dileo P, Dhooge C, Eriksson M, Fagioli F, Fedenko A, Ferraresi V, Ferrari A, Ferrari S, Frezza AM, Gaspar N, Gasperoni S, Gelderblom H, Gil T, Grignani G, Gronchi A, Haas RL, Hassan B, Hecker-Nolting S, Hohenberger P, Issels R, Joensuu H, Jones RL, Judson I, Jutte P, Kaal S, Kager L, Kasper B, Kopeckova K, Krákorová DA, Ladenstein R, Le Cesne A, Lugowska I, Merimsky O, Montemurro M, Morland B, Pantaleo MA, Piana R, Picci P, Piperno-Neumann S, Pousa AL, Reichardt P, Robinson MH, Rutkowski P, Safwat AA, Schöffski P, Sleijfer S, Stacchiotti S, Strauss SJ, Sundby Hall K, Unk M, Van Coevorden F, van der Graaf WTA, Whelan J, Wardelmann E, Zaikova O, Blay JY, ESMO Guidelines Committee, PaedCan and ERN EURACAN: Bone sarcomas: ESMO-PaedCan-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of oncology : official journal of the European Society for Medical Oncology 2018 Oct 1; 29:iv79-iv95 [PMID: 30285218]
- Kager L, Tamamyan G, Bielack S: Novel insights and therapeutic interventions for pediatric osteosarcoma. Future oncology (London, England) 2017, 13: 357 [PMID: 27651036]
- Marina N, Smeland S, Bielack S, Bernstein M, Jovic G, Krailo M, Hook J, Arndt C, van den Berg H, Brennan B, Brichard B, Brown K, Butterfass-Bahloul T, Calaminus G, Daldrup-Link H, Erksson M, Gebhardt M, Gelderblom H, Gerss J, Goldsby R, Goorin A, Gorlick R, Grier H, Hale J, Hall K, Hardes J, Hawkins D, Helmke K, Hogendoorn P, Isakoff M, Janeway K, Jürgens H, Kager L, Kühne T, Lau C, Leavey P, Lessnick S, Mascarenhas L, Meyers P, Mottl H, Nathrath M, Papai Z, Randall R, Reichardt P, Renard M, Safwat A, Schwartz C, Stevens M, Strauss S, Teot L, Werner M, Sydes M, Whelan J: Comparison of MAPIE versus MAP in patients with a poor response to preoperative chemotherapy for newly diagnosed high-grade osteosarcoma (EURAMOS-1): an open-label, international, randomised controlled trial . Lancet Oncol 2016, 17: 1396 [PMID: 27569442]
- Bielack SS, Hecker-Nolting S, Blattmann C, Kager L: Advances in the management of osteosarcoma. F1000Research 2016 Nov 25; 5: 2767 [PMID: 27990273]
- Whelan JS, Bielack SS, Marina N, Smeland S, Jovic G, Hook JM, Krailo M, Anninga J, Butterfass-Bahloul T, Böhling T, Calaminus G, Capra M, Deffenbaugh C, Dhooge C, Eriksson M, Flanagan AM, Gelderblom H, Goorin A, Gorlick R, Gosheger G, Grimer RJ, Hall KS, Helmke K, Hogendoorn PC, Jundt G, Kager L, Kuehne T, Lau CC, Letson GD, Meyer J, Meyers PA, Morris C, Mottl H, Nadel H, Nagarajan R, Randall RL, Schomberg P, Schwarz R, Teot LA, Sydes MR, Bernstein M, EURAMOS collaborators: EURAMOS-1, an international randomised study for osteosarcoma: results from pre-randomisation treatment. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO 2015, 26: 407 [PMID: 25421877]
- Bielack SS, Smeland S, Whelan JS, Marina N, Jovic G, Hook JM, Krailo MD, Gebhardt M, Pápai Z, Meyer J, Nadel H, Randall RL, Deffenbaugh C, Nagarajan R, Brennan B, Letson GD, Teot LA, Goorin A, Baumhoer D, Kager L, Werner M, Lau CC, Sundby Hall K, Gelderblom H, Meyers P, Gorlick R, Windhager R, Helmke K, Eriksson M, Hoogerbrugge PM, Schomberg P, Tunn PU, Kühne T, Jürgens H, van den Berg H, Böhling T, Picton S, Renard M, Reichardt P, Gerss J, Butterfass-Bahloul T, Morris C, Hogendoorn PC, Seddon B, Calaminus G, Michelagnoli M, Dhooge C, Sydes MR, Bernstein M, EURAMOS-1 investigators: Methotrexate, Doxorubicin, and Cisplatin (MAP) Plus Maintenance Pegylated Interferon Alfa-2b Versus MAP Alone in Patients With Resectable High-Grade Osteosarcoma and Good Histologic Response to Preoperative MAP: First Results of the EURAMOS-1 Good Response Randomized Controlled Trial. Journal of clinical oncology 2015, 33: 2279 [PMID: 26033801]
- Isakoff MS, Bielack SS, Meltzer P, Gorlick R: Osteosarcoma: Current Treatment and a Collaborative Pathway to Success. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2015 Sep 20; 33: 3029 [PMID: 26304877]
- Kager L, Bielack S: [Chemotherapeutic concepts for bone sarcomas]. Der Unfallchirurg 2014, 117: 517 [PMID: 24903502]
- Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F: WHO Classification of Tumours of Soft Tissue and Bone. WHO Classification of Tumours 4th edn. International Agency for Research on Cancer , Lyon, 2013
- Henrichs M-P, Hardes J, Jürgens H: Maligne Knochentumoren. in: Solide Tumoren im Kindesalter. Fuchs J (Hrsg.), Schattauer GmbH Stuttgart 2012, 330 [ISBN: 978-3-7945-2781-1]
- Bielack S: Osteosarkome. Leitlinie der Gesellschaft für Pädiatrische Onkologie und Hämatologie AWMF online, 2010 [URI: www.awmf.org]
- Bielack S, Carrle D: Diagnostik und multimodales Therapiekonzept des Osteosarkoms. ärztliches journal reise & medizin onkologie, Otto Hoffmanns Verlag GmbH 3/2007, S: 34
- Bielack S, Machatschek J, Flege S, Jürgens H: Delaying surgery with chemotherapy for osteosarcoma of the extremities. Expert Opin Pharmacother 2004, 5: 1243 [PMID: 15163270]
- Bielack S, Kempf-Bielack B, Delling G, Exner G, Flege S, Helmke K, Kotz R, Salzer-Kuntschik M, Werner M, Winkelmann W, Zoubek A, Jürgens H, Winkler K: Prognostic factors in high-grade osteosarcoma of the extremities or trunk. J Clin Oncol 2002, 20: 776 [PMID: 11821461]
- Bielack S, Flege S, Kempf-Bielack B: Behandlungskonzept des Osteosarkoms. Onkologe 2000, 6: 747 [DOI: 10.1007/s007610070064]
- Bielack S, Kempf-Bielack B, Schwenzer D, Birkfellner T, Delling G, Ewerbeck V, Exner G, Fuchs N, Göbel U, Graf N, Heise U, Helmke K, von Hochstetter A, Jürgens H, Maas R, Munchow N, Salzer-Kuntschik M, Treuner J, Veltmann U, Werner M, Winkelmann W, Zoubek A, Kotz R: Neoadjuvant therapy for localized osteosarcoma of extremities. Results from the Cooperative osteosarcoma study group COSS of 925 patients. Klin Pädiatr 1999, 211: 260 [PMID: 10472560]
 PDF-Datei der Patienten-Kurzinformation zum Osteosarkom (477KB)
PDF-Datei der Patienten-Kurzinformation zum Osteosarkom (477KB)
Autor: Maria Yiallouros, Dr. med. habil. Gesche Tallen
Stand: 04.02.2020