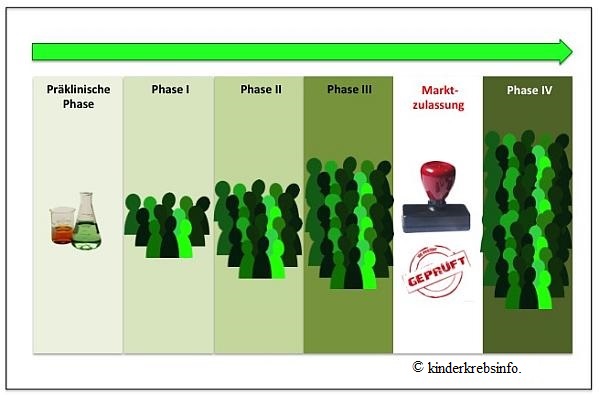
- Präklinische Phase - erfolgsversprechende Ergebnisse eines neuen Arzneimittels
- Phase-I-Studien - Erste Anwendung des neuen Arzneimittels am (gesunden) Menschen
- Phase-II-Studien - Erste Anwendung an einer kleinen Gruppe
- Phase-III-Studien - Erste Anwendung an einer größeren Gruppe
- Marktzulassung
- Phase-IV-Studien - Überwachung des Arzneimittels nach dessen Marktzulassung
Klinische Forschung
Autor: Dr. med. habil. Gesche Tallen, Zuletzt geändert: 26.02.2019
Wenn die präklinische Forschungsphase beendet ist (siehe. präklinische Forschung), und die Ergebnisse aus diesen Laborstudien erfolgsversprechend sind, muss das neue Medikament eine klinische Prüfung zur Wirksamkeit und Sicherheit beim Menschen durchlaufen. Dazu übergeben die Wissenschaftler des Forschungslabors, in dem die präklinischen Vorarbeiten erfolgt sind, das neue Arzneimittel in der Regel an einen Pharmakonzern. Die Zulassung für diese Übergabe unterliegt einem mehrstufigen Verfahren und erfolgt nach international standardisierten Kriterien (siehe Gesetzliche Vorgaben zur Prüfung von Arzneimitteln). Die klinische Prüfung am Menschen erfolgt dann im Rahmen so genannter klinischer Studien, die in unterschiedliche Phasen eingeteilt sowie streng kontrolliert und überwacht werden (siehe Klinische Studien).