Düşük Habislikte Gliom – Kısa Bilgiler
Merkezi sinir sisteminin (MSS) düşük maligniteye (habasete) sahip tümörleri (düşük habasetli gliomlar). Aşağıdaki yazıda hastalık tablosu, olası hastalık sebepleri ve bulguları, hastalığın seyri, tanısı, tedavi planlaması, tedavisi, tedavi iyileştirme çalışmaları, rehabilitasyonu, tedavi sonrası izlemi ve hastalığın prognozu hakkında detaylı bilgiler bulacaksınız.
yazar: Maria Yiallouros; Dr. med. habil. Gesche Tallen, erstellt am: 2007/04/20, editör: Maria Yiallouros, Yayın İzni: Dr. med. Astrid Gnekow (deutsch), Dr. med. Ebru Saribeyoglu (türkisch), türk tercüman: Sait Kont, Last modification: 2021/08/27 doi:10.1591/poh.patinfo.ng.kurz.1.20070627
Table of contents
Hastalık Tablosu
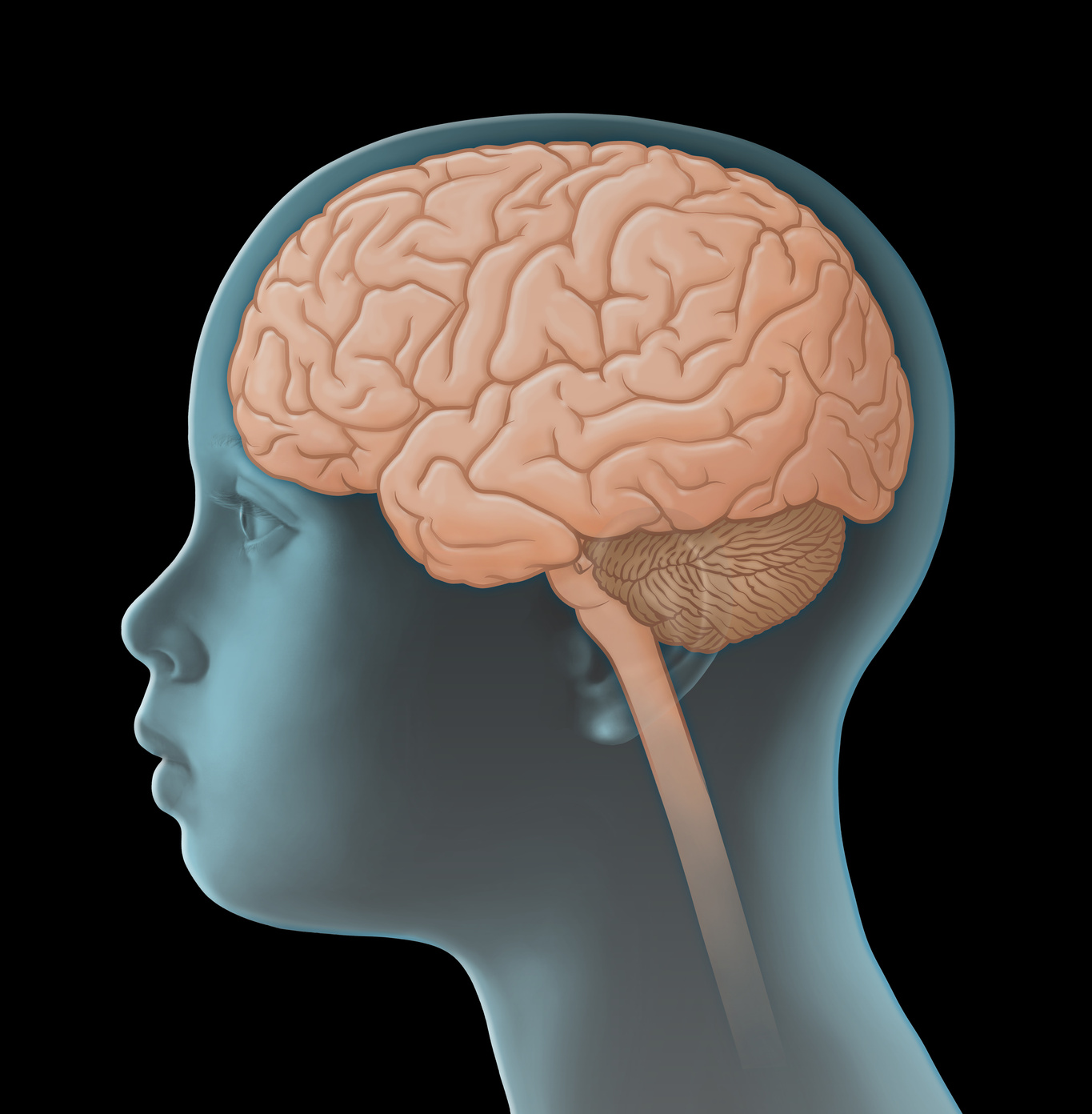
Düşük habislikte (habislik derecesi düşük, az kötü huylu) gliomlar, merkezi sinir sistemi (MSS) dahilinde rastlanan tümör türlerinden bazılarıdır. Bunlar solid yani kistik olmayan tümörlerdir ve beyin veya omurilik içindeki hücrelerin kontrolden çıkmaları sonucunda oluşurlar. Doğrudan doğruya merkezi sinir sisteminden kaynaklandıkları için, primer yani birincil MSS tümörü diye de adlandırılırlar. Bu nedenle diğer organlarda oluşan ve kötü huylu çoğalma (metastaz) yapan habis tümörlerden farklıdırlar.
Düşük habislikte gliom türleri prensip olarak merkezi sinir sisteminin her bölümünden ortaya çıkabilirler. Bu tümörlere en sık beyincik ve büyük beyin organının merkezi kesimlerinde rastlanır. Düşük habislikte gliom türleri genellikle çok yavaş gelişirler. Kafatası kemik yapısı sebebiyle büyüyen dokulara ancak sınırlı bir yer verebildiği için ve hayati öneme sahip beyin kesimlerinin tutulması söz konusu olduğu için, düşük habislikte gliomlar hayati tehlike oluşturabilirler.
Görülme sıklığı
Düşük habislikte gliomlar gençlerde ve çocuklarda görülen MSS tümörlerinin yaklaşık % 40 ile 50’sini oluştururlar. Düşük habislikte gliomlar her yaş grubunda görülebilirler. En sık görülme yaşı 5-11 yaş arasındadır. Almanya’da her sene 18 yaş altında 250 çocuk ve genç düşük habasette gliom tanısı almaktadır. Diğer bir deyişle her sene 100.000 çocuktan 2 veya 3 tanesi bu hastalığa yaka-lanmaktadır. Hastalık erkek çocuklarda kızlara göre biraz daha sık görülmek-tedir (cinsiyet oranı 1,2:1).
Düşük habislikte gliom türleri
Düşük habislikte gliomlar, mikroskopik görüntüleri itibariyle birbirlerinden farklı çok sayıda tümör tiplerini kapsamaktadır. Bunlar Dünya Sağlık Örgütü (WHO, Türkçesi DSÖ) sınıflamasına göre (DSÖ sınıflaması) düşük habislikte gliomlar WHO derecesi I veya II olarak sınıflandırılırlar.
Ikinci dereceden daha yüksek derecelere geçen (yüksek habaset gösteren) tümörler yetişkinlerde tanımlanmıştır, ancak bu durum çocukluk çağında muhtemelen çok nadirdir. Çeşitli araştırma projeleri kapsamında yürütülen çalışmalarla moleküler genetik incelemeler yapılmaktadır. Bu incelemeler çocuklarda görülen tümörlerdeki hücre değişimlerinin erişkinlerde görülen tümörlerden farklı olduğunu ortaya çıkarmıştır. Erişkinlerde görüldüğü gibi daha yük-sek dereceli gliomlara değişimin hangi yaştan itibaren ortaya çıkabileceğini kestirmek mümkün değildir.
Düşük habislikte gliomların nasıl büyüyeceklerini öngörmek mümkün değildir, ancak büyüme genellikle yavaş ve sadece oluşma noktasında sınırlı olarak gerçekleşmektedir. Hatta bazen büyümenin uzun süre durduğu da gözlenmektedir. Öte yandan tümörün çabuk ve saldırgan büyüdüğü de olmaktadır Tümör hücrelerinin beyin omurilik sıvısı (likör) üzerinden yayılma riski (metastaz oluşturma) genelde azdır, ama görme kanalı bölgesinde düşük habislikte gliomu bulunan küçük çocuklarda bu risk daha yüksektir.
Sebepleri
Düşük habislikte gliomlar, sinir destek dokusunun, yani glia hücrelerinin habis huylu değişikliğe uğramaları sonucunda oluşurlar. Bunun nedeni henüz hala tam olarak anlaşılamamıştır.
Bazı doğuştan gelen hastalığı olan çocuk ve gençlerde (örneğin nörofibromatozis tip 1 (NF), veya tuberöz skleroz hastalıklarında) düşük habislikte gliom türlerinden birine yakalanma riski belirgin derecede daha yüksektir. Örneğin tip 1 nörofibromatozis hastalarının yaklaşık % 20 kadarında düşük habislikte gliomlar oluşmaktadır. Bu durumda hastalık çoğu zaman görme kanalı bölgesinde belirmektedir. Ayrıca akut lösemi veya habis bir göz tümörü olan retinoblastom sebebiyle henüz çocuk yaşta iken kafatasına radyoterapi (ışınlanma) uygulanmış olması halinde de, sonradan bir beyin tümörü oluşma riski artmaktadır.
Hastalık belirtileri
Diğer merkezi sinir sistemi tümörlerinde [MSS tümörü] olduğu gibi, düşük dereceli gliomların ortaya çıkardıkları hastalık belirtileri, hastanın yaşına, tümörün merkezi sinir sistemi içinde bulunduğu yere ve yayılma derecesine bağlı olarak değişir. Hastalık belirtileri genel (spesifik olmayan) ve lokal (bölgesel, spesifik) olarak ayrılır.
Spesifik olmayan semptomlar-belirtiler
Spesifik olmayan genel semptomlar tümörün yerleşim yerinden bağımsızdırlar ve merkezi sinir sistemi tümörü dışında başka hastalıklarda da görülebilen bulgulardır. Bu bulgular baş ve/veya sırt ağrısı, baş dönmesi, iştahsızlık, sabah aç karna bulantı/kusma (beyin tümörlerinde tipik olarak yemeklerle ilişkisiz, genellikle aç karna ve sıklıkla sabahları yatar pozisyondayken olan kusma), kilo kaybı, artan yorgunluk hissi, performans düşüşü, konsantrasyon bozukluğu, kişilik değişimleri ve gelişimsel bozukluklar olabilir.
Bu semptomların sebebi kafatasının içinde (veya beyinomurilik kanalı içinde) yavaşça gelişen basınç artışıdır. Büyüyen tümör kitlesi kafa içi basıncı direkt arttırabileceği gibi tümör basısına bağlı olarak gelişen beyin omurilik sıvısının dolaşım bozukluğu da basınç artışına sebep olabilir. Beyin omurilik sıvısının dolaşımının bozulması hidrosefaliye de neden olur (beyin omurilik sıvısının kafa içinde birikmesi). Bu durumda bıngıldakları (fontanel) açık bebek ve küçük çocuklarda baş çevresinde hızlı bir artış meydana gelir (makrosefali-hidrosefali).
Spesifik semptomlar-belirtiler
Lokal (spesifik) semptomlar tümörün merkezi sinir sistemi içindeki yerini ve hangi işlevsel bölgeleri etkilediği konusunda bilgi verebilirler. Örneğin beyincik bölgesindeki bir düşük dereceli bir gliom denge ve yürüme bozukluklarına sebep olabilir. Beyin parankimindeki (büyük beyin) tümörler epilepsi nöbeti benzeri nöbetlere (sara nöbeti) yol açabilirler. Omurilik [omurilik] bölgesindeki tümörler ise çok çeşitli felçlere sebebiyet verebilirler. Görme bozuklukları, bilinç değişiklikleri, uyku bozuklukları da net olmamakla birlikte tümörün yerleşimi hakkında ipucu verebilirler.
Bilinmesinde yarar var: Düşük habislikte gliomlu çocuk ve gençlerde hastalık belirtileri, tümörün yavaş büyümesi nedeni ile genellikle sinsi bir şekilde oluşurlar.
Tanı
Doktor/çocuk doktoru muayene sırasında hastanın öyküsünde (anamnez) ve fiziksel muayenesinde merkezi sinir sistemine ait kötü huylu tümör olabileceğine dair veriler elde ederse, hastayı özellikle çocuk ve gençlerde kanser ve kan hastalıkları uzmanı bir kliniğe (Pediatrik Onkoloji ve Hematoloji Kliniğine) sevk edecek-tir. Çünkü böyle bir tümör şüphesi durumunda hastanın kötü huylu MSS tümörüne sahip olup olmadığının anlaşılabilmesi için değişik alanlardaki uzmanların birlikte çalışmaları ve geniş kapsamlı tetkiklerle bir sonuca varılması gerekmektedir. Hastanın en iyi sonucu verecek, en uygun tedaviyi alabilmesi için gliomun tipinin belirlenmesi ve vücuttaki yayılma evresinin saptanması da gereklidir.
Hastaya MSS tümörü tanısı konulabilmesi için ayrıntılı öykü (anamnez) ve fiziksel ve nörolojik muayene sonrasında çeşitli görüntüleme yöntemleri (bilgisayarlı tomografi - BT ve manyetik rezonans tomografisi - MR) yapılır. Bu yöntemler yardımıyla merkezi sinir sisteminde tümörün bulunup bulunmadığı, beyinde veya omurilik kanalında tümör yayılması yani metastaz olup olmadığı tespit edilebilir. Tümörün konumu, büyüklüğü, çevre dokuya olan sınırları ve hidrosefali kolayca saptanabilir. Görme kanalında bir tümör şüphesi durumunda çocuklar tecrübeli bir göz doktoruna sevk edilir ve ayrıntılı bir muayeneden geçirilir. Hastalık tipine ve tedavi seçeneklerine bağlı olarak gerekirse başka incelemeler de yapılabilir.
Tanıyı yani teşhisi kesin olarak sağlama alabilmek için mutlaka cerrahi yolla tümörden bir doku örneği alınmalıdır (biyopsi). Bu girişim, tedavi stratejisinin bir parçası olduğu için, mutlaka bu konuda uzmanlaşmış bir merkezde yapılmalıdır. Histolojik (histolojik) ve molekular genetiksel incelemeler için, bu konuda uzmanlaşmış patologların bir çok farklı tekniği kullanmaları gereklidir.
Girişimin çok rikli olduğunun düşünüldüğü bazı istisnai durumlarda, çocuk onkolojisi merkezlerinde bulunan interdisipliner doktor grubu biyopsi yapılmamasına karar verebilir. Örneğin görme kanalı bölgesinde ve ara beyin kesiminde bulunan tümörlerde doku incelemesinden feragat edilebilir. Bu durumda tanı düşük habesette gliomlar için karakteristik radyolojik bulgular ışığında konulur.
Tedavi planı
Tanı konduktan sonra tedavi planlanır. Mümkün olduğunca kişisel ve hastaya uyarlanmış (risk adaptasyonlu) bir tedavinin gerçekleştirilebilmesi amacıyla, tedavi ekibi planın hazırlanmasında hastadaki prognozu (sağkalım, tedavi yanıtı) etkileyen belirli faktörleri (risk ve prognoz faktörlerini) dikkate alır.
Düşük habislikte gliomlu hastalarda önemli prognoz faktörleri, tümörün cinsi, konumu, yayılması ve diğer yerlere sıçramasıdır. Buna dair bilgiler belirtilen tanı yöntemleri yardımıyla elde edilir. Diğer yandan hastanın yaşı ve genel sağlık durumu da önemli bir rol oynamaktadır. Tüm bu faktörler tedavi planı yapılırken göz önüne alınırlar. Bunun amacı, her hastada kendine göre mümkün olduğu ölçüde en iyi tedavi sonucuna ulaşmaktır.
Tedavi
Düşük dereceli (düşük habasetli) gliomlu hastaların tedavisi mutlaka çocuk onkolojisi merkezleri tarafından yapılmalıdır. Bu merkezlerde kanser hastası çocukların tedavisi konusunda en modern tedavi yöntemlerine alışık, eğitimli doktor ve sağlık ekipleri bulunmaktadır. Bu bölümlerde çalışan doktorlar hastalarını, hastalık tiplerine özgü çalışma grupları ile yakın temas halinde olarak birlikte geliştirdikleri ve sürekli yenilenen tedavi planlarına göre tedavi ederler. Tedavinin amacı yüksek oranda iyileşme sağlamanın yanında tedaviye bağlı yan etki ve geç dönem etkileri olabildiğince en aza indirmektir.
Tedavi öncelikle tümörün cerrahi olarak çıkarılması (beyin cerrahisi, nöroşirurji) ve ameliyatı takiben kontrollü hasta izleminden oluşur. Hastaların sadece bir kısmında cerrahiye ek olarak kemoterapi veya radyoterapiye (ışın tedavisi) gereksinim duyulur.
Ameliyat (cerrahi girişim, operasyon)
Düşük habislikteki gliomlarda tercih edilen ilk tedavi seçeneği tümörün cerrahi olarak çıkarılmasıdır (beyin cerrahisi ameliyatı). Yapılacak girişimin aciliyeti hastalık bulgularının ağırlığına ve tümörün konumuna göre değişir. Temel olarak amaç tümörün tamamen çıkarılmasıdır, çünkü yapılan çalışmalar göstermiştir ki hastalığın seyrini en çok etkileyen faktör cerrahi olarak tümörün tamamen çıkarılıp çıkarılamamış olmasıdır. Bu da demek oluyor ki, tamamen çıkarılabilmiş tümörlerde sağkalım çok daha yüksek olmaktadır.
İnterdisipliner doktor ekibi tümörün tamamen çıkarılmasının hasta için ne kadar risk taşıdığını, böyle bir girişimin mümkün olup olmadığını kendi arasında tartışır. Çünkü bazen tümörün merkezi sinir sistemindeki konumu nedeniyle nörolojik bakımdan ciddi olumsuz sonuçlara yol açmadan tümörün tamamen alınması her zaman mümkün olmamaktadır. Böyle durumlarda en başından tümörün sadece bir kısmının çıkarılabileceği veya sadece doku örneği alınmasının gerçekleştirilebileceği kararı verilir.
Tedavinin devamı
Tümörü tamamen çıkarılabilen çocuklarda, çok nadir durumlarda tümörün tekrar ortaya çıkması söz konusu olduğundan, sadece izlem öngörülmektedir. Tümörün tamamen çıkarılamadığı durumlarda hastanın sadece izlenip izlenmeyeceğine, ek tedavi olarak kemoterapi veya ışın tedavisi (radyoterapi) gerekip gerekmediğine karar verilmesi gereklidir. Tümörün tam olarak çıkarılamadığı durumlarda, hastanın sadece izlenip izlenmeyeceğine; cerrahi dışı kemoterapi veya ışın tedavisi (radyoterapi) ek bir tedaviye gerek olup olmadığına karar verilmesi gereklidir.
Tümörü kısmi olarak çıkarılabilmiş çocuk ve gençlerde de sağkalım oranları oldukça yüksektir. Bu nedenle, konunun uzmanları cerrahi dışı tedavi yöntemlerin sadece tanı sırasında bazı ağır klinik bulguları olan hastalarda uygulanması gerektiği konusunda hem fikirdirler. Tümürü kısmi olarak çıkarılabilmiş hastalar da sıklıkla kalan tümörün yeniden büyümesi söz konusu olmadığından ve kalan tümör parçası nedeni ile ağır klinik bulgular ortaya çıkmadığından, sadece izlenebilmektedirler (aynı tümörü tamamen çıkarılabilmiş hastalar gibi).
Eğer geride kalan tümör tekrar büyürse veya tümöre bağlı ortaya çıkan klinik bulgular ağırlaşırsa, öncelikle ikinci bir cerrahi girişimin az riskle yapılıp yapılamayacağı değerlendirilmelidir. Eğer bu mümkün değilse kemoterapi veya ışın tedavisi (radyoterapi) gündeme gelir. Bu durumda tedavi ekibi hangi cerrahi dışı tedavi seçeneğinin ve bu yöntemin en uygun hangi zamanda uygulanması gerektiğinin kararını verir.
Kısa zaman öncesine kadar cerrahi dışı tedavi seçeneği olarak kemoterapi mi ışın tedavisinin mi uygulanacağının kararının verilmesinde hastanın yaşı çok büyük önem taşımaktaydı. Çok küçük yaştaki hastalarda, ışın tedavisi uygulanamayacağı için öncelikle kemoterapi tercih edilmekteydi. Şu anki bil-giler ışığında uygulanan kemoterapinin daha sonra uygulanacak bir ışın tedavisinin etkinliğini azaltmadığını bilmekteyiz. Bu nedenle cerrahi dışı uygulanacak olan ilk tedavi seçeneğinin kemoterapi olması konusunda – bazı istisnalar hariç – uluslararası platformda fikir birliği mevcuttur. Eğer bu tedavi başarısız olursa veya hastalığın seyri sırasında yeni bir tedavi gerekliliği ortaya çıkarsa hastanın yaşı da göz önüne alınarak ışın tedavisi gündeme gelebilir. Nörofibromatozis tip 1 hastalarında, ışın tedavisinin geç yan etkilerinin ortaya çıkma olasılığı çok yüksek olduğundan kemoterapi tercih edilmelidir.
Tedavi iyileştirme araştırmaları ve veri bankası
Dünyanın büyük tedavi merkezlerinde düşük habislikte gliom hastası çocuk ve gençlere standart tedavi protokollu tedaviler uygulanmaktadır. Böylece tanı anında hastanın yaşı ve nörofibromatozis hastlığının olup olmaması da göz önüne alınarak tüm hastalar için ortak bir cerrahi dışı tedavi konsepti (şeması) oluşturulmuş olur. Çalışmaların ortak amacı, tümör büyümesini durdurmak ve hastada uzun vadede oluşabilecek yan etkileri (örneğin görme yollarındaki tümörlerde görme yetisi kaybını en aza indirmek) olabildiğince azaltmaktır. İşte bu nedenle cerrahi dışı tedaviler tedavi iyileştirme araştırmaları (tedavi protokolleri, tedavi şemaları) veya veri bankaları kapsamında gerçekleştirilmektedir.
Burada söz konusu olan kontrollü kliniksel araştırmalardır. Araştırmaların hedefi hastaları en güncel bilgi seviyesine göre tedavi etmek ve aynı zamanda tedavi olanaklarını daha iyileştirmek ve geliştirmektir. Tanı sırasında yürütülmekte olan bir tedavi iyileştirme çalışması bulunmayan durumlarda veya hastalar tedavi iyileştirme çalışmasına alınmak için yeterli kriterleri sağlamadılarında, bu hastalar register adı verilen veri bankaları önerileri doğrultusunda tedavi edilirler. Veri bankaları tedavi planlarını çalışma merkezi önerileri doğrultusunda yaparlar, böylece hastalar o güne kadar geçerli olan en güncel bilgiler ışığında tedavi edilmiş olurlar.
Halen Almanya’da çocuk ve gençlerde görülen düşük habasetli gliomlar için yürütülen güncel bir tedavi iyileştirme çalışması bulunmamaktadır. Bir önceki çalışma (SIOP-LGG 2004) 2012 yılında kapanmıştır ve yeni hasta almamaktadır. Yeni bir çalışma protokolü hazırlık aşamasındadır.
Halen Almanya’daki hastalar için uluslararası şu veri tabanları bulunmaktadır:
- Register SIOP-LGG 2004: Nisan 2012 yılından, 2018 yılı sonuna kadar düşük habasetli gliomu olan çocuk ve gençler SIOP-LGG 2004 veri tabanı önerilerine göre tedavi edildiler. Merkezi Augsburg’da olan (Yönetici: Dr. med. A. Gnekow) çalışma merkezi, 2012 yılında kapanan SIOP-LGG 2004 çalışmasının sonuçları ışığında veri tabanı kapsamında diğer tedavi merkezlerine tedavi konusunda destek oldular. 2019 yılı başından itibaren SIOP-LGG 2004-Register veri tabanı kapanmış bulunmaktadır. 2018 yılı sonuna kadar veri tabanı önerileri doğrultusunda tedavi almış hastalar, gene augsburg’daki çalışma merkezi tarafından izlenmeye devam edilecektir. Yeni tanı alan hastalar için ise LOGGIC-Register veri tabanı kullanılmaktadır (bakınız aşağısı).
- LOGGIC-Register: LOGGIC-Register veri tabanı (LOGGIC baş harfleri ingilizcedeki Low Grade Glioma In Children çocuklardaki düşük habasetli gliom keli-mesinin baş harflerinden oluşmaktadır) tüm Avrupa çapında 01.01.2019 tarihinden itibaren tanı alan 21 yaş altındaki düşük habe-setli gliomlu hastaları kapsamaktadır. Nisan 2019 yılında tanı konulan tümörlerin molekular biyolojik özelliklerinin kaydedildiği LOGGIC Core BioClinical veri bankası açılmıştır. Böylece LOGGIC-Register ve LOGGIC Core veri tabanları ile düşük habesetli gliomların tüm Avrupada tanısı (molekular tanısı dahil) mümkün olacaktır. Buradan elde edilecek verilerle tümör biyolojisi hakkındaki bilgiler derinleştirilecek ve bu hastalığa sahip çocuklar için yeni tedavi yöntemleri geliştirilmesi mümkün olacaktır. LOGGIC-Register veri tabanının merkezi Berlin Charite’de bulunan çocuk hematoloji onkoloji bilim dalında (Yönetici: PD Dr. med. P. Hernáiz Driever) LOGGIC Core veri bankasının merkezi ise aynı klinikte pediatrik hematoloji onkoloji immunoloji bilim dalında (yönetici Prof. Dr. med. O. Witt) bulunmaktadır.
Tedavi başarısı
Düşük habislikte gliomlu çocuk ve gençlerde tedavi son yirmi sene içinde uygulanan ortak tedavi stratejileri yardımıyla önemli boyutta olumlu bir gelişme göstermiştir. Bu olumlu gelişmeye modern tanı ve cerrahi yöntemleri de katkıda bulunmaktadır. Düşük habislikte gliomlu hastaların çoğu için yüksek oranda hayatta kalabilme şansı mevcuttur. Hastaların %90’dan fazlası uzun dönem sağkalmaktadır, ancak çoğunda artık tumor ve/veya tümöre veya tedaviye bağlı hasarlar mevcuttur.
Tedavi olanakları ve hastalığın seyri (prognoz) önemli ölçüde tümörün bulunduğu yere ve ameliyat edilebilirlik derecesine bağlıdır. Bunun da ötesinde nörolojik, oftalmolojik, intelektüel, hormonel ve psikososyal sorunlar (yan etkiler) yaşam kalitesini etkilemektedirler. Bundan sonra oluşturulacak tedavi konseptlerinin amacı sadece hastaların sağ kalım oranlarının arttırılması değil, risiko oluşma olasılığına göre adapte edilmiş tedavi stratejileri ile hastalığın ve tedavinin nörolojik, oftalmolojik, nöropsikolojik etkilerinin en aza indirilmesidir. Uygulanan tedavi yöntemlerinin hastanın yaşam kalitesine ve genel sağlığı üzerine etkilerini incelemek, bundan sonraki çalışmaların ağırlıklı konusu olacaktır.
Kaynakça 
- Kaatsch P, Grabow D, Spix C: German Childhood Cancer Registry - Anual Report 2018 (1980-2017). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz 2019 [URI: www.kinderkrebsregister.de]
- Fleischhack G, Rutkowski S, Pfister SM, Pietsch T, Tippelt S, Warmuth-Metz M, Bison B, van Velthoven-Wurster V, Messing-Jünger M, Kortmann RD, Timmermann B, Slavc I, Witt O, Gnekow A, Hernáiz Driever P, Kramm C, Benesch M, Frühwald MC, Hasselblatt M, Müller HL, Sörensen N, Kordes U, Calaminus G: ZNS-Tumoren. in: Niemeyer C, Eggert A (Hrsg.): Pädiatrische Hämatologie und Onkologie. Springer-Verlag GmbH Deutschland, 2. vollständig überarbeitete Auflage 2018, 359 [ISBN: 978-3-662-43685-1]
- Gnekow AK, Walker DA, Kandels D, Picton S, Giorgio Perilongo, Grill J, Stokland T, Sandstrom PE, Warmuth-Metz M, Pietsch T, Giangaspero F, Schmidt R, Faldum A, Kilmartin D, De Paoli A, De Salvo GL, of the Low Grade Glioma Consortium and the participating centers: A European randomised controlled trial of the addition of etoposide to standard vincristine and carboplatin induction as part of an 18-month treatment programme for childhood (≤16 years) low grade glioma - A final report. European journal of cancer (Oxford, England : 1990) 2017, 81: 206 [PMID: 28649001]
- Rutkowski S, Trollmann R, Korinthenberg R, Warmuth-Metz M, Weckesser M, Krauss J, Pietsch T: Leitsymptome und Diagnostik der ZNS-Tumoren im Kindes- und Jugendalter. Gemeinsame Leitlinie der Gesellschaft für Neuropädiatrie und der Gesellschaft für Pädiatrische Onkologie und Hämatologie 2016 [URI: www.awmf.org]
- Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, Ohgaki H, Wiestler OD, Kleihues P, Ellison DW: The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta neuropathologica 2016, 131: 803 [PMID: 27157931]
- Gnekow AK, Falkenstein F, von Hornstein S, Zwiener I, Berkefeld S, Bison B, Warmuth-Metz M, Driever PH, Soerensen N, Kortmann RD, Pietsch T, Faldum A: Long-term follow-up of the multicenter, multidisciplinary treatment study HIT-LGG-1996 for low-grade glioma in children and adolescents of the German Speaking Society of Pediatric Oncology and Hematology. Neuro-oncology 2012, 14: 1265 [PMID: 22942186]
- Hernáiz Driever P, von Hornstein S, Pietsch T, Kortmann R, Warmuth-Metz M, Emser A, Gnekow AK: Natural history and management of low-grade glioma in NF-1 children. J Neurooncol 2010, [PMID: 20352473]
- Calaminus G: Lebensqualität bei Kindern und Jugendlichen mit Hirntumoren. WIR Informationsschrift der Aktion für krebskranke Kinder e.V. (Bonn) 2004, 2: 6 [URI: www.kinderkrebsstiftung.de]
- Gnekow AK: Therapie von Gliomen niedriger Malignität im Kindes- und Jugendalter. WIR Informationsschrift der Aktion für krebskranke Kinder e.V. (Bonn) 2003, 2: 8 [URI: www.kinderkrebsstiftung.de]
- Schüz J, Kaatsch P: Epidemiology of pediatric tumors of the central nervous system. Expert Rev Neurotherapeutics 2002, 2: 469
- Kaatsch P, Rickert C, Kühl J, Schuz J, Michaelis J: Population-based epidemiologic data on brain tumors in German children. Cancer 2001, 92: 3155 [PMID: 11753995]
- Listernick R, Louis DN, Packer RJ, Gutmann DH: Optic pathway gliomas in children with neurofibromatosis 1: consensus statement from the NF1 Optic Pathway Glioma Task Force. Ann Neurol 1997, 41: 143 [PMID: 9029062]

 Düşük Habislikte Gliom - Kisa Bilgiler (470KB)
Düşük Habislikte Gliom - Kisa Bilgiler (470KB)