Akute myeloische Leukämie (AML) - Kurzinformation
Die akute myeloische Leukämie (AML) ist eine bösartige Erkrankung des blutbildenden Systems. In diesem Text erhalten Sie die wichtigsten Informationen zu Krankheitsbild und Krankheitsformen sowie zu Häufigkeit, möglichen Ursachen, Symptomen, Diagnose, Behandlung und Prognose der Erkrankung.
Autor: Maria Yiallouros, erstellt am: 02.02.2010, Freigabe: Prof. Dr. med. Ursula Creutzig, Zuletzt geändert: 12.09.2021 doi:10.1591/poh.patinfo.aml.kurz
Inhaltsverzeichnis
Krankheitsbild
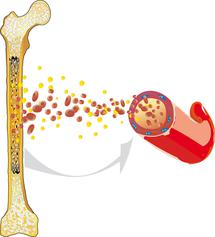
Die akute myeloische Leukämie (AML) – auch akute nicht lymphoblastische Leukämie genannt – ist eine bösartige Erkrankung des blutbildenden Systems. Sie entsteht im Knochenmark, dem Ort der Blutbildung, und geht im Allgemeinen mit einer Überproduktion unreifer weißer Blutzellen einher.
Normalerweise vermehren und erneuern sich alle Blutzellen in einem harmonischen Gleichgewicht. Sie durchlaufen dabei einen komplizierten Reifungsprozess. Bei der AML ist dieser Prozess außer Kontrolle geraten: Die weißen Blutkörperchen (Leukozyten) reifen nicht mehr zu funktionstüchtigen Zellen heran, sondern vermehren sich rasch und unkontrolliert. Sie verdrängen dadurch zunehmend die normale Blutbildung, so dass gesunde weiße Blutzellen sowie rote Blutzellen (Erythrozyten) und Blutplättchen (Thrombozyten) nicht mehr im notwendigen Umfang gebildet werden.
Blutarmut (Anämie), Infektionen und erhöhte Blutungsneigung können die Folge und zugleich auch das erste Anzeichen einer akuten Leukämie sein. Da die AML von Anfang an nicht auf eine bestimmte Stelle im Körper begrenzt ist, sondern vom Knochenmark aus das Blut, die lymphatischen Gewebe [lymphatisches System] und alle anderen Organe und somit ganze Organsysteme befallen kann, wird sie – wie alle Leukämien – auch als bösartige Systemerkrankung bezeichnet.
Die AML nimmt einen raschen Verlauf. Erfolgt keine Behandlung, kommt es durch die Ausbreitung der Leukämiezellen und der damit einhergehenden Schädigung der Körperorgane zu schweren Erkrankungen, die unbehandelt innerhalb weniger Wochen oder Monate zum Tod führen.
Häufigkeit
Die akute myeloische Leukämie (AML) ist – nach der akuten lymphoblastischen Leukämie (ALL) – mit knapp 20 % die zweithäufigste Leukämie bei Kindern und Jugendlichen. Ihr Anteil an der Gesamtheit aller bösartigen Erkrankungen im Kindes- und Jugendalter beträgt etwa 4 %. In Deutschland erkranken nach Angaben des Deutschen Kinderkrebsregisters (Mainz) pro Jahr circa 90 Kinder und Jugendliche im Alter von 0 bis 17 Jahren neu an einer akuten myeloischen Leukämie.
Die AML kann in jedem Alter auftreten, am häufigsten ist sie im höheren Erwachsenenalter. Im Kindes- und Jugendalter sind Säuglinge und Kleinkinder in den ersten beiden Lebensjahren am häufigsten betroffen. Das durchschnittliche Erkrankungsalter liegt bei 7 Jahren. Jungen erkranken etwas häufiger als Mädchen (Geschlechterverhältnis: 1,1 : 1).
Formen der akuten myeloischen Leukämie
Die AML entsteht durch die bösartige Veränderung (Entartung) unreifer myeloischer Zellen. Es handelt sich dabei um Stammzellen der Blutbildung (kurz: Blutstammzellen), aus denen im weiteren Entwicklungsverlauf – je nach Art der Stammzelle – bestimmte weiße Blutzellen (Granulozyten, Monozyten), rote Blutzellen oder Blutplättchen hervorgehen.
Bei der AML findet in der Regel eine Entartung in einer unreifen Vorläuferzelle der weißen Blutzellen, den Myeloblasten, statt. Prinzipiell können aber Vorläufer aller myeloischen Zellen entarten, so auch die der roten Zellreihe und die der Blutplättchen oder auch gemeinsame Vorläuferzellen. Da die bösartige Veränderung demnach verschiedene Zelltypen betreffen und zudem auf unterschiedlichen Reifungsstufen erfolgen kann, gibt es verschiedene Formen der AML (zum Beispiel Myeloblastenleukämie, Monoblastenleukämie, Erythroblastenleukämie, Megakaryozytenleuämien und verschiedene Mischformen). Bis vor kurzem wurden, je nach Herkunft der leukämischen Zellen, acht verschiedene Hauptformen der AML unterschieden. Heutzutage erfolgt die Einteilung in erster Linie anhand der genetischen Veränderungen, die die entarteten Zellen aufweisen.
Wichtig zu wissen: Es gibt verschiedene Formen der AML, die sich, was Krankheitsverlauf und Heilungsaussichten (Prognose) betrifft, zum Teil deutlich voneinander unterscheiden. Bei der Wahl der Behandlungsstrategie werden diese Unterschiede berücksichtigt.
Ursachen
Die Ursachen der akuten myeloischen Leukämie (AML) sind weitgehend unbekannt. Man weiß zwar, dass die Krankheit durch die bösartige Veränderung einer unreifen myeloischen Zelle entsteht und dass die Entartung mit Veränderungen im Erbgut der Zelle einhergeht. In den meisten Fällen bleibt jedoch unklar, warum genetische Veränderungen auftreten und warum sie bei manchen Kindern zur Erkrankung führen, bei anderen nicht. Nach heutigem Wissen müssen mehrere genetische Veränderungen zusammenkommen, bevor eine Leukämie entsteht.
Bekannt ist, dass Kinder und Jugendliche mit bestimmten ererbten oder erworbenen Immundefekten oder mit bestimmten Chromosomenveränderungen (zum Beispiel Down-Syndrom, Fanconi-Anämie) ein erhöhtes Risiko haben, an einer AML zu erkranken. Auch radioaktive Strahlen und Röntgenstrahlung, bestimmte chemische Substanzen und Medikamente, Zigaretten- oder Alkoholkonsum der Eltern und möglicherweise auch Viren können bei der Entstehung einer Leukämie eine Rolle spielen. Bei der Mehrheit der Patienten kennt man die krankheitsauslösenden Faktoren jedoch nicht.
Krankheitszeichen
Die Krankheitszeichen (Symptome), die mit einer akuten myeloischen Leukämie (AML) einhergehen, entwickeln sich meist innerhalb weniger Wochen. Sie sind auf die Ausbreitung der bösartigen Zellen im Knochenmark und in anderen Körperorganen und -geweben zurückzuführen. Die ungehemmte Teilung der Leukämiezellen im Knochenmark beeinträchtigt zunehmend die Produktion der normalen Blutzellen.
Kinder und Jugendliche, die an einer AML erkrankt sind, fallen deshalb meist zunächst durch allgemeine Krankheitszeichen wie Mattigkeit, Spielunlust und Blässe (Anämie) auf. Diese sind bedingt durch den Mangel an roten Blutkörperchen, deren Aufgabe es ist, den Sauerstoff in die Körperzellen zu transportieren. Durch den Mangel an funktionstüchtigen weißen Blutkörperchen (zum Beispiel Lymphozyten und Granulozyten) können Krankheitserreger nicht mehr ausreichend bekämpft werden; es stellen sich Infektionen ein, die sich durch Fieber bemerkbar machen. Das Fehlen von Blutplättchen, die für eine rasche Blutgerinnung sorgen, kann zu Haut- und Schleimhautblutungen führen.
Die Überhandnahme der Leukämiezellen im Körper führt, abgesehen von Veränderungen im Blutbild, zu Organbeschwerden: Das Wachstum der Leukämiezellen in den Hohlräumen der Knochen, im Knochenmark, kann Knochenschmerzen hervorrufen, vor allem in Armen und Beinen. Sie können so ausgeprägt sein, dass kleinere Kinder nicht mehr laufen mögen und getragen werden wollen. Die bösartigen Zellen können sich außerdem in Leber, Milz und Lymphknoten festsetzen, so dass diese Organe anschwellen und zu entsprechenden Beschwerden, zum Beispiel Bauchschmerzen, führen. Kein Organ ist grundsätzlich verschont. Bei Patienten mit einer AML kann es auch zu einem Befall der Hirnhäute kommen. Kopfschmerzen, Gesichtslähmungen, Sehstörungen und/oder Erbrechen können die Folge sein. Auch tumorartige Haut- oder Schleimhautveränderungen kommen vor.
Die wichtigsten Symptome sind in der folgenden Übersicht zusammengefasst:
Sehr häufig (bei über 60 % der Patienten):
- Müdigkeit, allgemeine Abgeschlagenheit und Lustlosigkeit, Krankheitsgefühl
- Hautblässe durch Mangel an roten Blutzellen (Anämie)
- Fieber und/oder erhöhte Infektneigung durch Mangel an weißen Blutzellen (Neutropenie)
- Bauchschmerzen und Appetitlosigkeit (durch Vergrößerung von Milz und/oder Leber)
Häufig bis relativ häufig (bei 20 bis 60 % der Patienten)
- Blutungsneigung ohne jedwede oder bei nur geringer Einwirkung von außen, zum Beispiel schwer zu stillendes Nasen- und/oder Zahnfleischbluten, blaue Flecken oder kleine punktförmige Hautblutungen (Petechien), selten Hirnblutungen
- Geschwollene Lymphknoten, etwa am Hals, in den Achselhöhlen oder in der Leiste
- Knochen- und Gelenkschmerzen
Selten (bei unter 20 % der Patienten)
- Kopfschmerzen, Sehstörungen, Erbrechen, Hirnnervenlähmungen (durch Befall des Zentralnervensystems)
- Atemnot (bei Hyperleukozytose)
- Hautveränderungen und Chlorome (Myeloblastome oder Myelosarkome): tumorförmige Ansammlungen von Leukämiezellen in der Haut, den Lymphknoten oder im Knochen, manchmal um die Augen herum, zum Teil blau-grün gefärbt
- Zahnfleischwucherungen (so genannte Gingivahyperplasie)
- Vergrößerung der/eines Hoden
Gut zu wissen: Die Symptome einer AML können individuell sehr verschieden stark ausgeprägt sein. Wichtig zu wissen ist auch, dass das Auftreten eines oder mehrerer der genannten Krankheitszeichen nicht unbedingt bedeuten muss, dass eine Leukämie vorliegt. Viele dieser Symptome treten bei vergleichsweise harmlosen Erkrankungen auf, die mit Leukämie nichts zu tun haben. Bei Beschwerden ist es jedoch ratsam, so bald wie möglich einen Arzt zu konsultieren, um deren Ursache zu klären. Liegt tatsächlich eine akute Leukämie vor, muss schnellstmöglich mit der Therapie begonnen werden.
Diagnose
Findet der (Kinder-)Arzt durch Krankheitsgeschichte (Anamnese) und körperliche Untersuchung des Patienten Hinweise auf eine akute Leukämie, wird er zunächst eine umfassende Blutuntersuchung vornehmen. Wenn sich, durch bestimmte Veränderungen im Blutbild, der Verdacht auf eine Leukämie erhärtet, ist eine Entnahme von Knochenmark (Knochenmarkpunktion) zur Sicherung der Diagnose notwendig. Zu diesem Zweck und für eventuell sich anschließende Untersuchungen wird der Arzt den Patienten in ein Krankenhaus überweisen, das auf Krebs- und Bluterkrankungen bei Kindern und Jugendlichen spezialisiert ist (Klinik für pädiatrische Onkologie/Hämatologie).
Blut- und Knochenmarkuntersuchungen
Blut- und Knochenmarkuntersuchungen erlauben eine genaue Aussage darüber, ob und an welcher Art von Leukämie der Patient erkrankt ist. Die Untersuchungen beinhalten mikroskopische (zytomorphologische), immunologische und genetische Laborverfahren. Diese ermöglichen es nicht nur, eine AML von anderen Leukämiearten (zum Beispiel einer ALL) abzugrenzen, es lassen sich auch innerhalb des Krankheitsbildes AML verschiedene Unterformen unterscheiden. Dies ist eine wichtige Voraussetzung für eine gezielte Therapieplanung, denn es hat sich gezeigt, dass sich die verschiedenen AML-Formen nicht nur auf zellulärer und molekularer Ebene voneinander unterscheiden, sondern auch deutliche Unterschiede in ihrem Krankheitsverlauf, ihren Heilungsaussichten (Prognose) und der Therapierbarkeit zeigen.
Untersuchungen zur Ausbreitung der Erkrankung
Liegt eine AML vor, so ist es für die Behandlungsplanung auch wichtig zu wissen, ob außerhalb des Knochenmarks noch weitere Organe des Körpers – zum Beispiel Gehirn, Leber, Milz, Lymphknoten, Haut oder Knochen – von Leukämiezellen befallen sind. Auskunft darüber geben verschiedene bildgebende Verfahren wie Ultraschall- und Röntgenuntersuchung, im Bedarfsfall auch Magnetresonanztomographie (MRT), Computertomographie (CT) und/oder die Skelett-Szintigraphie. Um herauszufinden, ob auch das Zentralnervensystem (Gehirn und Rückenmark) von der Erkrankung betroffen ist, wird außerdem aus dem Nervenwasserkanal eine Probe entnommen und auf Leukämiezellen untersucht (Lumbalpunktion).
Untersuchungen vor Therapiebeginn
Behandlungsvorbereitend erfolgt ferner eine Überprüfung der Herzfunktion (Elektrokardiographie [EKG] und Echokardiographie) und der Gehirnfunktion (Elektroenzephalographie, EEG). Umfangreiche Laboruntersuchungen dienen dazu, den Allgemeinzustand des Patienten zu überprüfen und festzustellen, ob durch die Leukämie die Funktionen einzelner Organe (zum Beispiel Nieren und Leber) beeinträchtigt sind oder Stoffwechselstörungen vorliegen, die vor oder während der Behandlung besonders berücksichtigt werden müssen. Veränderungen, die möglicherweise im Laufe der Therapie auftreten, können aufgrund solcher Ausgangsbefunde besser beurteilt werden. Im Hinblick auf eventuell notwendig werdende Bluttransfusionen muss eine Bestimmung der Blutgruppe erfolgen.
Gut zu wissen: Nicht alle Untersuchungen sind bei jedem Patienten notwendig. Ihr Behandlungsteam wird Sie darüber informieren, welche diagnostischen Verfahren bei Ihnen oder Ihrem Kind zur Therapieplanung erforderlich sind.
Behandlung
Besteht oder bestätigt sich der Verdacht auf eine akute myeloische Leukämie (AML), muss der Patient schnellstmöglich in einer kinderonkologischen Behandlungseinrichtung behandelt werden. Dort ist das hoch qualifizierte Fachpersonal (Ärzte, Fachpflegekräfte) auf die Behandlung krebskranker Kinder spezialisiert und mit den modernsten Therapieverfahren vertraut. Die Ärzte dieser Klinikabteilungen stehen in fachorientierten Arbeitsgruppen in ständiger, enger Verbindung miteinander und behandeln ihre Patienten nach gemeinsam entwickelten und stetig weiter verbesserten Therapieplänen. Ziel der Behandlung ist, eine hohe Heilungsrate bei möglichst geringen Nebenwirkungen und Spätfolgen zu erreichen.
Behandlungsmethoden
Im Zentrum der Behandlung eines Patienten mit akuter myeloischer Leukämie (AML) steht die intensive Chemotherapie. Man versteht darunter eine Behandlung mit zellwachstumshemmenden Medikamenten (Zytostatika). Da ein einzelnes Medikament in der Regel nicht ausreicht, um alle Leukämiezellen zu vernichten, werden Kombinationen verschiedenartig wirkender Zytostatika eingesetzt (Polychemotherapie). Auf diese Weise soll die größtmögliche Wirkung gegen die bösartigen Zellen erzielt werden.
Chemotherapie-Abweichungen bei Down-Syndrom und APL: Bei Patienten mit einem Down-Syndrom ist eine weniger intensive Chemotherapie erforderlich als bei anderen AML-Betroffenen. Bei Patienten mit akuter Promyelozytenleukämie (APL) – einer Sonderform der AML – kann fast ganz auf die Chemotherapie verzichtet werden. Diese Patienten erhalten anstelle von Zytostatika andere Medikamente (siehe hierzu unsere Kapitel Kapitel „Therapie Down-Syndrom“ und „Therapie APL" im ausführlichen Patiententext).
In wenigen Fällen wird die Chemotherapie durch eine Bestrahlung des Zentralnervensystems (Schädelbestrahlung) ergänzt. Bei Patienten, die nicht gut auf die Standardtherapie ansprechen, ein hohes Rückfallrisiko haben oder einen Krankheitsrückfall erleiden, ist eine Hochdosis-Chemotherapie mit anschließender Stammzelltransplantation (Stammzelltherapie) eine weitere Möglichkeit der Behandlung.
Die Behandlung zielt darauf ab, die Leukämiezellen im Körper möglichst vollständig zu vernichten, so dass das Knochenmark seine Funktion als blutbildendes Organ wieder aufnehmen kann. Therapiebegleitend erfolgen unterstützende Behandlungsmaßnahmen, die der Vermeidung von Komplikationen dienen. Diese so genannte Supportivtherapie stellt bei Patienten mit AML einen wichtigen Teil der Behandlung dar.
Gut zu wissen: Die Intensität und Dauer einer Chemotherapie, die Notwendigkeit einer Strahlentherapie oder Stammzelltransplantation sowie die Prognose der Erkrankung richten sich unter anderem danach, an welcher AML-Unterform der Patient erkrankt ist, wie stark sich die Leukämiezellen im Körper bereits ausgebreitet haben und wie die Leukämie auf die Therapie anspricht. Denn davon hängt es ab, welcher Therapiegruppe der Patient zugeordnet wird (Standardrisikogruppe, mittlere Risikogruppe oder Hochrisikogruppe) und nach welchem Therapieplan er folglich behandelt wird.
Behandlungsablauf
Prinzipiell (abgesehen von den oben genannten Therapieabweichungen bei Patienten mit Down-Syndrom oder APL) besteht die Therapie aus verschiedenen Therapiephasen, die sich hinsichtlich ihrer Dauer und der eingesetzten Medikamentenkombinationen voneinander unterscheiden und unterschiedliche Ziele verfolgen. Wichtige Therapieelemente sind:
- die Induktionstherapie: Sie besteht aus einer besonders intensiven Chemotherapie und zielt darauf ab, innerhalb kurzer Zeit die Mehrzahl der Leukämiezellen zu vernichten, das heißt, eine Remission herbeizuführen. Die Induktionstherapie umfasst zwei Chemotherapie-Blöcke und dauert mit Erholungspause etwa zwei Monate.
- die Konsolidierungs- und Intensivierungstherapie schließt sich an die Induktionstherapie an und besteht aus drei Blöcken einer ebenfalls intensiven Chemotherapie, zum Teil mit anderen Medikamentenkombinationen. Ihr Ziel ist, die noch verbliebenen Leukämiezellen im Körper zu vernichten und so das Risiko eines Krankheitsrückfalls zu minimieren. Die Intensivierungstherapie dauert etwa drei bis vier Monate.
- die ZNS-Therapie: Es handelt sich dabei um eine vorbeugende (prophylaktische) oder therapeutische Behandlung des Zentralnervensystems (ZNS). Sie soll verhindern, dass sich Leukämiezellen im Gehirn oder Rückenmark ansiedeln oder weiter ausbreiten. Die ZNS-Therapie erfolgt während der systemischen Chemotherapie in Form mehrerer Medikamentengaben in den Nervenwasserkanal (intrathekale Chemotherapie). Wenn sich Leukämiezellen im Zentralnervensystem befinden, wird zusätzlich im Anschluss an die Intensivtherapie eine etwa zwei- bis dreiwöchige Strahlentherapie des Kopfes (Schädelbestrahlung) durchgeführt.
- die Erhaltungs- oder Dauertherapie: Sie besteht aus einer milderen Chemotherapie, die insgesamt ein Jahr dauert und vorwiegend ambulant erfolgt. Ihr Ziel ist, durch eine möglichst lange Therapiedauer all jene Leukämiezellen zu vernichten, die trotz der intensiven Behandlung überlebt haben.
Manche Patienten (mit großen Leukämiezellzahlen im Blut oder starkem Organbefall) erhalten vor der eigentlichen Therapie eine so genannte Vortherapie (zytoreduktive Vorphase). Der Zweck dieser etwa einwöchigen Behandlung besteht darin, die Leukämiezellen auf eine schrittweise und damit für den Organismus möglichst schonende Weise zu reduzieren, um Komplikationen (besonders Blutungen oder auch das Zellzerfalls- oder Tumorlyse-Syndrom) zu vermeiden.
Die Gesamtdauer der Therapie beträgt somit in der Regel etwa eineinhalb Jahre (sofern keine Stammzelltransplantation erforderlich ist und kein Rückfall eintritt). Der intensive Behandlungsteil (etwa sechs Monate) ist mit vielen stationären Klinikaufenthalten verbunden, Erholungspausen zwischen den Chemotherapiegaben können aber zu Hause stattfinden, wenn keine Probleme (wie Fieber oder Infektionen) auftreten. Während der eher gemäßigten, längeren Dauertherapie-Phase (circa ein Jahr) kann der Patient zu Hause sein. Allerdings muss er regelmäßig in die Tagesklinik oder in die Ambulanz kommen.
Therapieoptimierungsstudien und Register
Fast alle Kinder und Jugendlichen mit akuter myeloischer Leukämie (AML) werden in Deutschland im Rahmen von Therapieoptimierungsstudien behandelt. Es handelt sich dabei um kontrollierte klinische Studien, die das Ziel haben, erkrankte Patienten nach dem jeweils aktuellsten Wissensstand zu behandeln und gleichzeitig die Behandlungsmöglichkeiten zu verbessern und weiter zu entwickeln. Da viele Behandlungszentren beteiligt sind, spricht man auch von „multizentrischer“ Studie.
Patienten, die an keiner Studie teilnehmen, entweder weil zum Zeitpunkt ihrer Erkrankung keine Studie verfügbar ist oder weil sie die Einschlusskriterien einer bestehenden Studie nicht erfüllen, werden oft in einem so genannten Register dokumentiert. Die Behandlung erfolgt generell nach den Therapieempfehlungen der Studienzentrale. Auf diese Weise erhält der Patient die zu diesem Zeitpunkt verfügbare optimale Therapie.
Zurzeit gibt es in Deutschland, in der Regel mit internationaler Beteiligung, die im Folgenden genannten Therapiestudien und Register zur Behandlung von Kindern und Jugendlichen mit AML:
- Register AML-BFM 2017: Seit Anfang 2018 können sich alle AML-Patienten unter 18 Jahren im Register AML-BFM 2017 erfassen lassen (welches das Register AML-BFM 2012 ablöst). Das gilt für Patienten mit AML-Ersterkrankung ebenso wie mit Krankheitsrückfall oder einer AML als Zweitmalignom. Dokumentiert werden auch Patienten mit akuter Promyelozytenleukämie (APL) und, Kinder und Jugendliche mit Down-Syndrom, sofern sie nicht im Rahmen einer Studie behandelt werden (siehe unten). Ebenfalls erfasst werden Neugeborene mit Down-Syndrom, die an einem so genannten transient-myeloproliferativem Syndrom (TMD) erkrankt sind, einer Krankheit, die häufig in eine myeloische Leukämie übergeht. Die Registerzentrale erhofft sich mit der flächendeckenden Erfassung aller AML-Erkrankungen und deren Behandlung ein verbessertes Verständnis der AML und eine weitere Optimierung der Therapie. Für Patienten, die an keiner Studie teilnehmen, bietet die Registerzentrale Therapieempfehlungen, um die derzeit optimale Behandlung weiterhin zu gewährleisten.
- Studie AML-BFM 2012: Von Ende 2014 bis Anfang 2019 konnten Kinder und Jugendliche (unter 18 Jahren) mit einer AML-Ersterkrankung (ausgenommen: Patienten mit akuter Promyelozytenleukämie, Down-Syndrom und/oder transientem myeloproliferativem Syndrom) an der internationalen, multizentrischen Therapieoptimierungsstudie AML-BFM 2012 teilnehmen. Zahlreiche pädiatrisch-onkologische Kinderkliniken und Behandlungseinrichtungen in ganz Deutschland sowie weiteren europäischen Ländern waren daran beteiligt. Seit Februar 2019 ist diese Studie für die Patienten-Neuaufnahme geschlossen, die Studienergebnisse werden derzeit ausgewertet. Neu erkrankte Patienten können sich in das Register AML-BFM 2017 melden (siehe oben). Die Behandlung erfolgt gemäß gegenwärtiger Standardtherapie-Empfehlung.
- Studie ML-DS 2018: Für Kinder mit einem Down-Syndrom und myeloischer Leukämie (kurz: ML-DS) steht seit Februar 2021 die Therapieoptimierungsstudie ML-DS 2018 zur Verfügung. Zugelassen sind Patienten ohne GATA1-Mutation, die älter als 6 Monate, aber unter 4 Jahre alt sind, ODER Patienten mit GATA1-Mutation, die über 4 Jahre und unter 6 Jahre alt sind. Die Studie soll zeigen, ob bei Patienten mit gutem Therapieansprechen eine weitere Reduzierung der Therapieintensität (und somit der Nebenwirkungen) möglich ist. Zahlreiche Behandlungseinrichtungen in ganz Deutschland und anderen europäischen Ländern nehmen an der Studie teil.
Anmerkung: Die Studienzentrale für die Studie ML-DS 2018 befindet sich am Universitätsklinikum Halle (Saale) unter der Leitung von Prof. Dr. Jan-Henning Klusmann. Alle weiteren Studien und Register werden von der Studienzentrale an der Klinik für Kinderheilkunde des Universitätsklinikums Essen betreut (Studienleitung: Prof. Dr. med. Dirk Reinhardt).
Prognose
Die Heilungschancen (Prognose) von Kindern und Jugendlichen mit akuter myeloischer Leukämie (AML) haben sich dank der großen Therapiefortschritte in den letzten vier Jahrzehnten deutlich verbessert. Die heute eingesetzten modernen Untersuchungsmethoden und intensiven, standardisierten Kombinationschemotherapien führen dazu, dass fünf Jahre nach der Diagnosestellung über 70-75 % der an AML erkrankten Kinder und Jugendlichen am Leben sind (5-Jahres-Überlebensraten).
Dies bedeutet allerdings auch, dass für etwa 30 % aller AML-Patienten eine Heilung heute noch nicht möglich ist. Der Hauptgrund dafür ist die hohe Zahl der Krankheitsrückfälle (Rezidive) nach zunächst erfolgreicher Behandlung: Fast ein Drittel aller AML-Patienten ist davon betroffen. Darüber hinaus gibt es Patienten, deren Erkrankung von Anfang an nicht oder nur unzureichend auf die Behandlung anspricht (etwa 10 %), also keine Remission eintritt. Die Ärzte bezeichnen dies als Therapieversagen.
Die Prognose für den einzelnen Patienten hängt in erster Linie davon ab, an welchem genetischen Subtyp der AML er erkrankt ist und wie gut die Krankheit auf die Behandlung anspricht: Patienten mit günstigen Leukämiezelleigenschaften und gutem Therapieansprechen können Heilungsraten von bis zu 90 % erreichen. Bei Patienten mit ungünstigen Prognosefaktoren dagegen kann die Heilungschance weit unter 70 % betragen, auch wenn eine intensivierte Therapie eingesetzt wird. Patienten mit Ersterkrankung einer akuten Promyelozytenleukämie (APL) haben aufgrund einer geringeren Rückfallwahrscheinlichkeit eine 10-Jahres-Überlebensrate von über 90 % und somit eine bessere Prognose als Patienten mit anderen AML-Subtypen.
Bei einem Krankheitsrückfall sind die Heilungsaussichten im Allgemeinen ungünstig, vor allem dann, wenn er sich zu einem frühen Zeitpunkt, das heißt, noch vor Ablauf eines Jahres nach Erreichen einer Erstremission, ereignet. Das Gleiche gilt für Patienten, die von Anfang an nicht auf die Therapie ansprechen. Bei diesen Patienten kann jedoch mit einer erneuten Chemotherapie (Rezidivtherapie) und anschließender Stammzelltransplantation noch eine Heilung erzielt werden. Der Behandlungserfolg für die Gesamtheit der Patienten mit AML-Rezidiv liegt derzeit bei etwa 40% (5-Jahres-Überleben). Im Rahmen der derzeitigen Therapieoptimierungsstudien sowie zukünftiger Studien sollen die Heilungsaussichten auch für diese Patienten weiter verbessert werden.
Anmerkung: Bei den genannten Heilungsraten handelt es sich um statistische Größen. Sie stellen nur für die Gesamtheit der an einer AML erkrankten Patienten eine wichtige und zutreffende Aussage dar. Ob der einzelne Patient geheilt werden kann oder nicht, lässt sich aus der Statistik nicht vorhersagen. Eine Leukämieerkrankung kann selbst unter günstigsten beziehungsweise ungünstigsten Voraussetzungen ganz unerwartet verlaufen.
Literatur 
- Erdmann F, Kaatsch P, Grabow D, Spix C: German Childhood Cancer Registry - Annual Report 2019 (1980-2018). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz 2020 [URI: www.kinderkrebsregister.de]
- Creutzig U, Dworzak M, Reinhardt D: Akute myeloische Leukämie (AML) im Kindes- und Jugendalter. Leitlinie der Gesellschaft für Pädiatrische Onkologie und Hämatologie AWMF [URI: www.awmf.org]
- Creutzig U, Dworzak M, von Neuhoff N, Rasche M, Reinhardt D: [Acute Promyelocytic Leukemia: New treatment strategies with ATRA and ATO - AML-BFM-Recommendations]. Klinische Padiatrie 2018, 230: 299 [PMID: 30399642]
- Creutzig U, Reinhardt D: Akute myeloische Leukämien. in Niemeyer CH, Eggert A (Hrsg.): Pädiatrische Hämatologie und Onkologie 2018 [ISBN: 3540037020]
- Uffmann M, Rasche M, Zimmermann M, von Neuhoff C, Creutzig U, Dworzak M, Scheffers L, Hasle H, Zwaan CM, Reinhardt D, Klusmann JH: Therapy reduction in patients with Down syndrome and myeloid leukemia: the international ML-DS 2006 trial. Blood 2017 Jun 22; 129: 3314 [PMID: 28400376]
- Creutzig U, Dworzak MN, Bochennek K, Faber J, Flotho C, Graf N, Kontny U, Rossig C, Schmid I, von Stackelberg A, Mueller JE, von Neuhoff C, Reinhardt D, von Neuhoff N: First experience of the AML-Berlin-Frankfurt-Münster group in pediatric patients with standard-risk acute promyelocytic leukemia treated with arsenic trioxide and all-trans retinoid acid. Pediatric blood & cancer 2017, Epub ahead of print [PMID: 28111878]
- Arber DA, Orazi A, Hasserjian R, Thiele J, Borowitz MJ, Le Beau MM, Bloomfield CD, Cazzola M, Vardiman JW: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016 May 19; 127: 2391 [PMID: 27069254]
- Creutzig U ,Zimmermann M, Dworzak MN, Ritter J, Schellong G, Reinhardt D: Development of a curative treatment within the AML-BFM studies. Klinische Padiatrie 2013, 225 Suppl 1:S79 [PMID: 23700063]
- Rossig C, Jürgens H, Schrappe M, Moericke A, Henze G, von Stackelberg A, Reinhardt D, Burkhardt B, Woessmann W, Zimmermann M, Gadner H, Mann G, Schellong G, Mauz-Koerholz C, Dirksen U, Bielack S, Berthold F, Graf N, Rutkowski S, Calaminus G, Kaatsch P, Creutzig U: Effective childhood cancer treatment: The impact of large scale clinical trials in Germany and Austria. Pediatric blood & cancer 2013, 60: 1574 [PMID: 23737479]
- Kaspers GJ, Zimmermann M, Reinhardt D, Gibson BE, Tamminga RY, Aleinikova O, Armendariz H, Dworzak M, Ha SY, Hasle H, Hovi L, Maschan A, Bertrand Y, Leverger GG, Razzouk BI, Rizzari C, Smisek P, Smith O, Stark B, Creutzig U: Improved Outcome in Pediatric Relapsed Acute Myeloid Leukemia: Results of a Randomized Trial on Liposomal Daunorubicin by the International BFM Study Group. J Clin Oncol 2013, 31: 599 [PMID: 23319696]
- Reinhardt D, Von Neuhoff C, Sander A, Creutzig U: [Genetic Prognostic Factors in Childhood Acute Myeloid Leukemia]. Klinische Padiatrie 2012, 224: 372 [PMID: 22821298]
- Creutzig U, van den Heuvel-Eibrink MM, Gibson B, Dworzak MN, Adachi S, de Bont E, Harbott J, Hasle H, Johnston D, Kinoshita A, Lehrnbecher T, Leverger G, Mejstrikova E, Meshinchi S, Pession A, Raimondi SC, Sung L, Stary J, Zwaan CM, Kaspers GJ, Reinhardt D, AML Committee of the International BFM Study Group: Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel. Blood 2012, 120: 3187 [PMID: 22879540]
- Sander A, Zimmermann M, Dworzak M, Fleischhack G, von Neuhoff C, Reinhardt D, Kaspers GJ, Creutzig U: Consequent and intensified relapse therapy improved survival in pediatric AML: results of relapse treatment in 379 patients of three consecutive AML-BFM trials. Leukemia 2010 [PMID: 20535146]
- Niewerth D, Creutzig U, Bierings MB, Kaspers GJ: A review on allogeneic stem cell transplantation for newly diagnosed pediatric acute myeloid leukemia. Blood 2010, [PMID: 20538803]
- von Neuhoff C, Reinhardt D, Sander A, Zimmermann M, Bradtke J, Betts DR, Zemanova Z, Stary J, Bourquin JP, Haas OA, Dworzak MN, Creutzig U: Prognostic Impact of Specific Chromosomal Aberrations in a Large Group of Pediatric Patients With Acute Myeloid Leukemia Treated Uniformly According to Trial AML-BFM 98. Journal of clinical oncology 2010, 28: 2682 [PMID: 20439630]
- Zwaan MC, Reinhardt D, Hitzler J, Vyas P: Acute leukemias in children with down syndrome. Pediatric clinics of North America 2008, 55: 53 [PMID: 18242315]
- Belson M, Kingsley B, Holmes A: Risk factors for acute leukemia in children: a review. Environmental health perspectives 2007, 115: 138 [PMID: 17366834]
 PDF-Datei der Patienten-Kurzinformation zur akuten myeloischen Leukämie (AML) (468KB)
PDF-Datei der Patienten-Kurzinformation zur akuten myeloischen Leukämie (AML) (468KB)
Autor: Maria Yiallouros, Prof. Dr. med. Ursula Creutzig
Stand 20.04.2021