Острые миелоидные лейкозы (ОМЛ): краткая информация (AML)
Острый миелобластный (или миелоидный) лейкоз (ОМЛ) - это рак кроветворной системы. В нашем тексте Вы получите важную информацию о самой болезни, какие у неё бывают формы, как часто ею заболевают дети и почему, на какие симптомы надо обратить внимание, как ставят диагноз, как лечат детей и какие у них шансы вылечиться от этой формы рака.
автор: Dipl. Biol. Maria Yiallouros, erstellt am: 2010/02/02, редактор: Dr. Natalie Kharina-Welke, Разрешение к печати: Prof. Dr. med. Ursula Creutzig, Переводчик: Dr. Natalie Kharina-Welke, Последнее изменение: 2021/07/12 doi:10.1591/poh.patinfo.aml.kurz
Оглавление
- Что такое острый миелоидный лейкоз?
- Как часто встречаются ОМЛ у детей?
- Какие бывают формы ОМЛ?
- Почему дети заболевают ОМЛ?
- Какие бывают симптомы болезни?
- Как диагностируются острые миелоидные лейкозы?
- Как лечат острые миелоидные лейкозы?
- По каким протоколам лечат детей?
- Какие шансы вылечиться от острого миелоидного лейкоза?
Что такое острый миелоидный лейкоз?
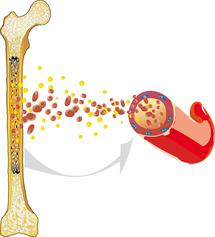
Острый миелоидный лейкоз, который сокращённо также называют ОМЛ (по первым буквам болезни), а иногда можно встретить название острый нелимфобластный лейкоз - это злокачественное заболевание кроветворной системы. Болезнь начинается в костном мозге. Наш костный мозг - это "фабрика" разных клеток крови. Когда "заболевает" костный мозг, то эта "фабрика" вместо здоровых (врачи говорят о зрелых клетках) начинает "выпускать" огромное количество незрелых белых клеток крови.
Когда человек не болен, то все клетки крови растут и обновляются очень гармонично, всё происходит сбалансированно. Клетки крови созревают постепенно, а сам процесс созревания достаточно сложный. Но когда ребёнок заболевает острым миелобластным лейкозом, то есть ОМЛ, то процесс созревания ломается полностью. Белые кровяные тельца, то есть лейкоциты, вдруг перестают созревать полностью и не дорастают до полноценных рабочих клеток. Вместо этого они начинают быстро и бесконтрольно делиться. Работа системы кроветворения всё больше даёт сбои: больные клетки вытесняют здоровые и занимают их место в костном мозге. У больного ребёнка не хватает ни здоровых лейкоцитов, ни красных клеток крови (эритроцитов), ни кровяных пластинок (тромбоцитов).
Именно поэтому у детей могут появляться малокровие (анемия), разные инфекционные осложнения (инфекция) и частые кровотечения. И это те первые симптомы, которые могут говорить об остром лейкозе у ребёнка. Но сама болезнь, ОМЛ, уже с самого начала не находится в какой-то одной части организма. Из костного мозга она уходит в кровь, в лимфоидные ткани (лимфатическая система) и во все другие органы. Начинает нарушаться работа всей системы органов, то есть всего организма. Именно поэтому ОМЛ, как и все другие виды лейкозов, называют системной злокачественной болезнью, то есть болезнь выводит из строя весь организм как систему.
ОМЛ распространяется по организму очень быстро. Без лечения лейкозные клетки расходятся везде, не встречая препятствий. Органы, куда они попали, перестают нормально работать и в них начинаются новые тяжёлые заболевания. Если лейкоз не лечить, то смерть наступает через несколько недель или месяцев.
Как часто встречаются ОМЛ у детей?
Если посмотреть на все виды лейкозов у детей и подростков, то острые миелоидные лейкозы занимают второе место, почти 20% (на первом месте стоят острые лимфобластные лейкозы, ОЛЛ). А среди всех форм рака у детей и подростков ОМЛ занимают около 4,2 %. По статистике в Германии в Детском Раковом Регистре (г. Майнц) ежегодно регистрируется около 80 детей и подростков в возрасте от 0 до 14 лет с диагнозом ОМЛ. А общее количество заболевших в возрасте до полных 18 лет ежегодно составляет примерно 100 человек.
Заболеть ОМЛ можно в любом возрасте. Чаще всего болеют пожилые люди. У детей и подростков острый миелобластный лейкоз наиболее часто встречается у грудных детей и детей до двух лет. А мальчики болеют немного чаще, чем девочки.
Какие бывают формы ОМЛ?
Когда ребёнок заболевает ОМЛ, то это значит, что в организме произошла мутация (злокачественное изменение) незрелых миелоидных клеток [клетка]. Когда мы говорим о незрелых клетках, мы имеем в виду стволовые клетки в системе кроветворения. Их ещё называют гемопоэтические стволовые клетки. Именно из них (в зависимости от типа стволовой клетки) начинают вырастать определённые виды лейкоцитов (гранулоциты, моноциты), эритроциты или тромбоциты.
Когда ребёнок заболевает ОМЛ, то чаще всего ломаются незрелые клетки-предшественники белых клеток крови. Эти клетки называются миелобласты. Хотя в принципе сломаться может любая клетка-родоначальница абсолютно всех миелоидных клеток. Например, могут мутировать клетки-предшественники, из которых потом созревают красные клетки крови и тромбоциты, или вообще могут мутировать общие клетки-родоначальники. Злокачественная мутация может произойти абсолютно с любым типом клетки. Кроме того клетка-предшественник может мутировать в абсолютно любой момент своего роста (созревания). Именно поэтому существует много разных форм ОМЛ (например, миелобластный лейкоз, монобластный лейкоз, эритробластный лейкоз, мегакариоцитарный лейкоз, также бывают смешанные формы). До недавнего времени ОМЛ было принято делить на восемь основных форм – в зависимости от того, какая клетка-предшественник мутировала в лейкозную. Сегодня специалисты смотрят на генетические [генетический] мутации, которые есть в раковых клетках. И в зависимости от этого говорят об определённой форме лейкоза.
Важно знать: бывают разные формы или подварианты ОМЛ. Между собой они могут сильно отличаться. Болезнь может протекать совершенно по-другому и шансы на выздоровление (на языке специалистов - прогноз) тоже разные. Когда врачи решают, как именно они будут лечить больного ребёнка, они обязательно учитывают все различия и специфику.
Почему дети заболевают ОМЛ?
Никто точно не знает, почему дети заболевают острым миелоидным лейкозом (ОМЛ). Известно, что ребёнок заболевает, когда ещё не созревшая миелоидная клетка начинает злокачественно изменяться. С этих повреждений начинается генетическая мутация клетки. Но чаще всего остаётся непонятным, почему произошли генетические изменения, и почему одни дети с такими изменениями заболели, а другие - нет. Сегодня учёные говорят о том, что если одновременно совпали несколько генетических изменений, то возникает лейкоз.
Известно, что у детей и подростков с определённым врождённым или приобретённым иммунодефицитом [дефекты иммунитета], или если у них есть определённые хромосомные отклонения (например, синдром Дауна, анемия Фанкони), есть высокая предрасположенность заболеть одной из форм миелобластного лейкоза. Также определённое влияние на то, что начинается лейкоз, могут оказывать радиация и рентгеновское излучение, некоторые химические вещества и медикаменты, привычки родителей (курение или чрезмерное употребление алкоголя), а также определённые вирусы. Однако, у большинства детей невозможно точно понять, что именно послужило причиной болезни.
Какие бывают симптомы болезни?
Первые симптомы, с которых начинается лейкоз (ОМЛ), чаще всего появляются буквально за несколько недель. Это происходит потому, что лейкозные клетки начинают заполнять костный мозг, а также другие органы и ткани в организме. Раковые клетки продолжают делиться в костном мозге, не встречая никаких препятствий. Поэтому костный мозг больше не может "выпускать" нормальные клетки крови в нужном количестве.
Поэтому чаще всего, что замечают родители у заболевшего ОМЛ ребёнка, это общие симптомы болезненного состояния. Дети вялые, бледные (анемия) и не хотят играть. Такое болезненное состояние происходит из-за того, что в организме не хватает эритроцитов. А именно они переносят кислород ко всем клеткам организма. Из-за того, что ребёнку начинает не хватать здоровых белых клеток крови (например, лимфоцитов и гранулоцитов), его организм больше не может нормально бороться с разными возбудителями болезней. Дети начинают болеть разными инфекциями, часто с высокой температурой. А из-за того, что становится мало тромбоцитов, которые отвечают за быстрое свёртывание крови, у ребёнка могут высыпать как бы точечные кровоизлияния на коже и начинают кровоточить слизистые оболочки.
Когда в организме лейкозных клеток становится больше, то меняются не только показатели в анализах крови. У детей появляются новые жалобы, если раковые клетки попадают в разные органы. Например, когда лейкозные клетки продолжают расти в полостях костей и в костном мозге, то у детей прежде всего начинают болеть руки и ноги. Боли могут быть такими сильными, что малыши вообще перестают ходить и просятся на руки. Также лейкозные клетки могут попасть в печень, в селезёнку и в лимфатические узлы. Они там как бы оседают, растут дальше. А органы, куда попали опухолевые клетки, начинают отекать. И тогда дети могут жаловаться, например, на боли в животе. По большому счёту никакой орган нашего организма не защищён от лейкозных клеток. Раковые клетки также могут проникать в мозговые оболочки. Если это произошло, то у заболевшего ребёнка может болеть голова, может появиться паралич лицевого нерва, ребёнок перестаёт хорошо видеть и/или его рвёт. Также бывает, что у детей на коже или на слизистых появляются изменения, которые врачи называют опухолевидными изменениями.
Назовём самые важные симптомы:
Очень часто (то есть они бывают у более, чем 60 % заболевших детей):
- Утомляемость, общая слабость и состояние "ничего не хочется", болезненное самочувствие
- Бледная кожа, т.к. мало эритроцитов (анемия)
- Высокая температура и/или частые инфекции, потому что мало лейкоцитов (нейтропения)
- Болит живот и нет аппетита (из-за того, что увеличились селезёнка и/или печень)
Достаточно часто (то есть они бывают у 20 до 50 % заболевших детей)
- Появляется кровоточивость, хотя нет каких-то внешних воздействий, или эти воздействия минимальные. Например, начинает кровоточить нос и/или дёсны, и эти кровотечения удаётся с трудом останавливать; появляются "беспричинные" синяки или маленькие точечные кровоизлияния на коже (на языке специалистов - петехии); реже встречается кровоизлияние в мозг
- Увеличенные лимфатические узлы, например, на шее, под мышками или в паху
- Болят кости и суставы
Редко (то есть они бывают у менее 20 % заболевших детей)
- Болит голова, нарушается зрение, появляется рвота, не двигаются лицевые нервы (если лейкозные клетки попали в центральную нервную систему, ЦНС, то могут парализоваться черепно-мозговые нервы)
- Затрудняется дыхание, появляется одышка (например, если у ребёнка гиперлейкоцитоз)
- Появляются изменения на коже и хлоромы (в этом случае врачи также могут говорить о миелобластоме или миелоидной саркоме). То есть раковые клетки не расходятся по организму, а скапливаются в коже, в лимфатических узлах или в костях, иногда вокруг глаз. И эти опухолевидные изменения бывают зелёного цвета, иногда с голубым оттенком
- На дёснах появляются наросты (врачи говорят о гипертрофии тканей десны)
- У мальчиков может быть увеличено одно яичко, или сразу оба
Полезно знать: у детей с ОМЛ могут быть совершенно разные симптомы. В каждом конкретном случае они проявляются индивидуально. Важно понимать, что если у Вашего ребёнка есть один, или даже несколько симптомов, то это ещё не значит, что ребёнок заболел лейкозом. Многие симптомы, которые есть в списке, появляются при других болезнях, сравнительно менее коварных. И они не имеют никакого отношения к лейкозу. Тем не менее мы рекомендуем как можно скорее обратиться к врачу, чтобы выяснить точную причину, почему у ребёнка появились какие-то жалобы. Если диагноз острого лейкоза подтверждается, то лечить болезнь нужно начинать максимально быстро.
Как диагностируются острые миелоидные лейкозы?
Если в истории болезни (анамнез) и после наружного осмотра [наружный осмотр] у педиатра появляется подозрение на острый лейкоз, то сначала врачу нужно посмотреть на результаты развёрнутого анализа крови. Если по анализам крови подозрение на лейкоз усиливается, то для подтверждения диагноза у ребёнка обязательно надо делать анализ костного мозга (пункция костного мозга). Для этого, а также для других дополнительных исследований врач направляет ребёнка в клинику, которая специализируется на лечении рака и болезней крови у детей и подростков (клиника детской онкологии и гематологии).
Какие необходимы анализы крови и костного мозга?
По анализам крови и костного мозга можно точно сказать, заболел ли ребёнок лейкозом, и если да – то каким именно видом лейкоза. Такие лабораторные исследования как цитоморфологический, иммунологический и генетический анализ дают информацию не только о том, какой именно вид лейкоза у ребёнка (например, это ОМЛ или ОЛЛ). Более того, по результатам этих исследований врачи могут точно сказать, какой именно вариант ОМЛ они нашли у ребёнка. Без этого невозможно точно спланировать терапию. Как показывает практика лечения болезни, разные варианты ОМЛ отличаются друг от друга на клеточном и молекулярном (молекулярный) уровне. При этом сама болезнь протекает у детей совершенно по-разному. Также есть разница в том, насколько высоки шансы на выздоровление (прогноз) и насколько конкретный вид лейкоза чувствителен к терапии.
Как исследуют лейкоз в других органах?
Как только диагноз ОМЛ подтвердили, то прежде чем составлять план лечения, специалистам надо знать, успели лейкозные клетки уйти в другие органы, например, в головной мозг, печень, селезёнку, лимфатические узлы, в кожу или в кости. Или лейкозные клетки растут пока только в костном мозге. Более точную информацию дают такие методы диагностики по снимкам (визуальная диагностика) как ультразвуковое исследование (УЗИ), и рентгеновское. Если в каком-то конкретном случае есть необходимость, то делаются также снимки МРТ (магнитно-резонансная томография), КТ (компьютерная томография) и/или сцинтиграфия костей скелета. Также, чтобы узнать, ушла ли болезнь в центральную нервную систему (то есть в головной и спинной мозг), берут пробу спинномозговой жидкости (люмбальная пункция). Её исследуют специалисты и ищут там лейкозные клетки.
Какую диагностику надо выполнить до начала лечения?
Перед лечением у ребёнка проверяют, как работает сердце (выполняется электрокардиограмма, ЭКГ и эхокардиограмма, ЭхоКГ) и как работает головной мозг (выполняется электроэнцефалограмма, ЭЭГ). Также специалисты делают много лабораторной диагностики, проверяя общее состояние работы организма. То есть они смотрят, как лейкоз, возможно, повлиял на работу некоторых органов (например, как у ребёнка работают почки или печень). Или у ребёнка, возможно, появились какие-то нарушения обмена веществ (метаболические нарушения) и на это надо обратить внимание не только до лечения, но и особенно во время лечения. Когда врачи знают, какие анализы были у ребёнка до лечения, они могут лучше понимать те изменения, которые могут произойти в организме во время лечения, а значит они могут лучше оценивать ситуацию в целом. Учитывая, что во время лечения, возможно, придётся делать переливание крови, у ребёнка обязательно заранее устанавливают группу крови [группа крови].
Полезно знать: Различных анализов и исследований очень много, но не все они обязательно делаются каждому ребёнку. Ваши лечащие врачи расскажут, какую именно диагностику необходимо сделать Вашему ребёнку, чтобы оптимально спланировать его лечение.
Как лечат острые миелоидные лейкозы?
Если врач подозревает, что у ребёнка острый миелоидный лейкоз (ОМЛ), либо анализы уже подтверждают этот диагноз, то ребёнка максимально быстро направляют в клинику, которая специализируется на лечении рака у детей (детский онкологический центр/ клиника детской онкологии и гематологии). В таких клиниках собраны специалисты высочайшей квалификации (врачи и другой медицинский персонал), которые специализируются именно на лечении разных форм рака у детей и подростков. Они работают по самым современным программам терапии (протоколам). В этих больницах врачи разного профиля входят в рабочие группы, которые всегда находятся в тесном контакте. Вместе они составляют планы лечения, обсуждают и ведут своих пациентов. Программы терапии регулярно усовершенствуются. Их цель – вылечить ребёнка в максимально щадящем режиме, то есть с минимальными побочными осложнениями и отдалёнными последствиями.
Какие бывают методы лечения?
Основным видом лечения детей с острым миелоидным лейкозом (ОМЛ) являются курсы интенсивной химиотерапии. Химиотерапия - это лечение препаратами, которые блокируют рост клеток (специалисты называют такие препараты цитостатики). Как правило, один такой препарат не может убить все опухолевые клетки. Поэтому врачи работают с комбинациями из разных цитостатиков, которые по-разному действуют на раковые клетки (когда специалисты говорят о курсах полихимиотерапии, то это и есть комбинации цитостатиков). И таким образом можно максимально эффективно бороться с лейкозными клетками.
Особые схемы химиотерапии: дети с синдромом Дауна синдром Дауна получают менее интенсивные курсы химиотерапии, чем все остальные. Дети с острым промиелоцитарным лейкозом (это вариант острого миелоидного лейкоза, его сокращённо называют ОПЛ, также принято международное обозначение М3) вообще могут не получать курсы химиотерапии. Вместо цитостатиков они получают другие препараты (более подробную информацию о лечении детей с синдромом Дауна можно прочитать на немецком языке в разделе Therapie Down-Syndrom, о лечении детей с ОПЛ можно прочитать на немецком языке в разделе Therapie APL).
Иногда кроме химиотерапии детям необходимо облучение ЦНС (специалисты говорят в этом случае о краниальном облучении, то есть об облучении головного мозга). Те дети, у которых болезнь с самого начала не отвечала на стандартное лечение, у которых высокая вероятность рецидива или у которых рецидив уже произошёл (то есть болезнь вернулась), другим вариантом лечения могут быть курсы высокодозной химиотерапии [высокодозная химиотерапия]. Сразу после них делают трансплантацию костного мозга (трансплантация стволовых клеток).
Цель лечения – по возможности полностью убить лейкозные клетки во всём организме, чтобы костный мозг снова смог заработать как кроветворный орган. Дополнительно, чтобы избежать осложнений во время лечения, дети кроме основной терапии получают вспомогательное лечение (специалисты могут говорить о поддерживающем лечении, также они используют термин сопроводительная терапия). Так называемая сопроводительная терапия занимает важное место в плане лечения детей с ОМЛ.
Полезно знать: насколько интенсивной будет химиотерапия у ребёнка, как долго она будет длиться, необходимо ли ребёнку облучение или трансплантация стволовых клеток, каковы шансы вылечиться (прогноз) - всё это зависит от того, какой именно вариант ОМЛ нашли у ребёнка, насколько лейкозные клетки уже успели разойтись по организму к тому моменту, когда поставили точный диагноз, а также, как болезнь отвечает на лечение. От ответов на эти вопросы зависит, в какую группу риска попадает ребёнок (группа стандартного риска, группа среднего риска, или группа высокого риска) и соответственно по какому терапевтическому плану его будут лечить.
Как проходит лечение
Принципы лечения детей с острым миелобластным лейкозом состоят в том, что само лечение делится на определённые фазы (исключение составляют лишь особые схемы химиотерапии для детей с синдромом Дауна и с острым промиелоцитарным лейкозом, ОПЛ. Об этом мы писали выше). Эти фазы лечения отличаются друг от друга тем, в течении какого времени они проводятся, какие комбинации препаратов используются на каждом конкретном этапе, и какие именно цели стоят перед началом каждой фазы. Итак, всё лечение состоит из следующих этапов:
- Индукция: это начальный этап, когда проводится особо интенсивная химиотерапия (специалисты также могут говорить об индукционной терапии или об индукционном режиме терапии). На этом этапе цель лечения состоит в том, чтобы за короткое время убить максимум лейкозных клеток. То есть, как говорят врачи, ребёнок должен выйти в ремиссию (ремиссия). Индукция состоит из двух блоков химиотерапии. Вместе с перерывом между блоками этот этап продолжается приблизительно два месяца.
- Консолидация и интенсификация терапии: этот этап проводится сразу после индукции (специалисты также могут говорить о консолидации ремиссии). Дети также получают интенсивную химиотерапию, которая состоит из трёх блоков. Но в них появляются в том числе новые комбинации препаратов. На этом этапе цель лечения – уничтожить те лейкозные клетки, которые смогли выжить. Таким образом врачи стремятся максимально снизить вероятность того, что болезнь может вернуться (рецидив).
- Терапия ЦНС: этот этап может быть профилактикой нейролейкоза или лечением нейролейкоза. То есть, на этом этапе ребёнок либо получает такое лечение, чтобы опухолевые клетки не попали в центральную нервную систему (в головной мозг или спинной мозг), и тогда говорят о профилактике нейролейкоза. Либо, если в ЦНС уже нашли лейкозные клетки, то лечение должно помешать им расходиться дальше по центральной нервной системе, и в этом случае говорят о лечении нейролейкоза. Терапия ЦНС состоит в том, что в спинномозговой канал несколько раз медикаменты вводят интратекально (специалисты говорят об интратекальной химиотерапии). Если лейкозные клетки попали в центральную нервную систему, то есть их там нашли, то после этапа интенсивной терапии дети дополнительно получают лучевую терапию, которая длится от двух до трёх недель (специалисты говорят о краниальном облучении, то есть об облучении головного мозга).
- Поддерживающая терапия или длительная поддерживающая терапия: на этом этапе ребёнок регулярно получает химиотерапию, которая не такая интенсивная, как была раньше (невысокие дозы химиопрепаратов). Этот этап длится около года. Ребёнок может находиться дома, то есть лечение в основном проходит амбулаторно. Цель этого этапа состоит в том, чтобы воздействовать на организм в течение длительного времени и таким образом уничтожать все те опухолевые клетки, которые смогли выжить даже после интенсивной терапии.
Те дети, у которых в крови было очень высокое количество лейкозных клеток (в этом случае врачи говорят об инициальном гиперлейкоцитозе), или у них было тяжёлое поражение других органов (в этом случае врачи говорят о значительной органомегалии), перед основным лечением получают предварительную терапию, так называемая циторедуктивная профаза. Это предварительное лечение длится одну неделю. Его цель состоит в том, чтобы лейкозные клетки убивались постепенно и одновременно бережно для организма ребёнка. То есть врачи стремятся избежать критических ситуаций (особенно высоки риски того, что начнётся кровотечение, или синдром лизиса опухоли (синдром распада опухоли), когда быстро разрушаются раковые клетки и в организме начинается метаболический кризис, он может угрожать жизни ребёнка).
Таким образом всё лечение длится примерно около полутора лет, если ребёнку не была нужна трансплантация стволовых клеток и у него не было рецидива (общая длительность терапии). Когда проводятся этапы лечения с интенсивной химиотерапией (в общей сложности они составляют около 6 месяцев), дети должны находиться в онкогематологических отделениях. В перерывах между блоками химиотерапии они могут находиться у себя дома, если не появляются какие-то проблемы (например, высокая температура, или инфекция). Во время этапа длительной поддерживающей терапии, когда лечение длится достаточно долгое время (около года) и не является таким интенсивным, дети могут находятся дома. Но они остаются под постоянным наблюдением, то есть они должны регулярно приходить на контрольные обследования в дневной стационар или в амбулаторное отделение, когда ведёт приём детский онкогематолог.
По каким протоколам лечат детей?
В Германии почти всех детей и подростков с острым миелоидным лейкозом (ОМЛ) лечат по стандартизированным протоколам. В Германии такие программы/ протоколы лечения называются исследования оптимизации терапии. Немецкие протоколы, или исследования оптимизации терапии, - это клинические исследования, они строго контролируются. Их цель – не только лечить заболевших детей по самым современным разработкам, но и одновременно увеличивать эффективность лечения. Когда работают такие исследовательские протоколы, это значит, что одновременно лечат детей и исследуют конкретную форму рака. Поэтому в итоге появляются новые подходы к лечению. Так как в таких протоколах работает много клиник и лечебных центров, то у специалистов принято говорить о "мультицентровых" исследованиях.
Те дети, которые не проходят лечение по исследовательскому протоколу, либо потому, что в этот момент времени новый исследовательский протокол ещё не открылся, либо ребёнок не проходил по критериям, которые являются обязательными для включения в такой протокол, попадают в лечебный регистр. Принципиально они получают лечение по терапевтическим рекомендациям из центрального исследовательского офиса по конкрентной форме рака. То есть дети получают наиболее оптимальные схемы лечения, которые имеются на данный момент времени.
Сегодня в Германии работают следующие исследовательские протоколы и лечебные регистры по лечению ОМЛ у детей и подростков (как правило, с международным участием):
- Лечебный AML-BFM 2017: с начала 2018 г. в него попадают все дети и подростки (до 18 лет) с ОМЛ (этот регистр сменил старый лечебный регистр AML-BFM 2012). Это могут быть и дети, которые впервые заболели ОМЛ (первичные пациенты), и дети с рецидивом болезни, и те дети, у которых диагноз ОМЛ - это вторичная злокачественная опухоль. Также в регистр включаются дети с острым промиелоцитарным лейкозом (для него принято международное сокращение APL) а также те, у кого есть синдром Дауна, если они не попадают на лечение в исследовательский протокол (см. ниже). Также лечебный регистр ведёт новорожденных с синдромом Дауна, у которых нашли так называемый транзиторно миелопролиферативный синдром (ещё можно встретить другое название так называемое преходящее миелопролиферативное расстройство. В классификации ВОЗ принято сокращение TMD [transient myeloproliferative disorder]. Эта болезнь очень часто позже переходит в миелоидный лейкоз). Исследовательский офис лечебного регистра надеется, что сбор данных по всем пациентам Германии со всеми видами и формами ОМЛ, а также по их лечению, даст более глубокое понимание сути болезни и таким образом позволит оптимизировать терапию, то есть найти новые подходы к лечению. Для тех детей и подростков, которые не лечатся ни по одному из действующих исследовательских протоколов, центральный научно-исследовательский офис регистра даёт терапевтические рекомендации, чтобы обеспечивать наиболее оптимальный результат лечения на настоящий момент.
- Исследовательский протокол AML-BFM 2012: с конца 2014 г. до начала 2019 г. дети и подростки (до 18 лет), первичные пациенты, могли лечиться по международному мультицентровому исследовательскому протоколу AML-BFM 2012. В этот протокол не попадали дети с острым промиелоцитарным лейкозом (ОПЛ), дети с синдромом Дауна и/или дети с транзиторно миелопролиферативным синдромом. По этому исследовательскому протоколу работали многочисленные детские клиники и детские онкологические центры по всей Германии и других европейских стран. С февраля 2019 г. приём новых пациентов в этот протокол закрыт. Новые пациенты попадают в лечебный регистр AML-BFM 2017 (смотри выше). Лечение идёт по современным рекомендациям стандартной терапии.
- Исследовательский протокол ML-DS 2018: для детей с синдромом Дауна и миелоидным лейкозом (для этой комбинации заболеваний принято международное сокращение ML-DS) в феврале 2021 г. открылся новый исследовательский протокол ML-DS 2018. В него допускаются пациенты, у которых нет мутации гена GATA1, возраст которых старше 6 месяцев, но младше 4 лет. Или же допускаются пациенты, у которых есть мутация гена GATA1, но они старше 4 лет и младше 6 лет. Результаты исследовательского протокола должны показать, возможно ли снизить интенсивность терапии для пациентов с хорошим ответом на лечение (и таким образом снизить побочные воздействия и осложнения от лечения). В протоколе работают многочисленные клиники по всей Германии и других европейских стран.
Обращаем внимание: Центральный научно-исследовательский офис протокола ML-DS 2018 находится в университетской клинике города Хаале (Заале), руководитель - профессор, доктор медицины Ян-Хеннинг Клусманн. Центральный научно-исследовательский офис других исследовательских протоколов и лечебных регистров находится в Центре детской онкологии и гематологии университетской клиники города Эссен, руководителем является профессор, доктор медицины Дирк Райнхардт.
Какие шансы вылечиться от острого миелоидного лейкоза?
Вероятность вылечиться (врачи говорят в этом случае о прогнозе) от острого миелоидного лейкоза (ОМЛ) у детей и подростков значительно выросла за последние сорок лет. Этого удалось достичь благодаря современным подходам в диагностике (появились новые методы исследований), были введеные более интенсивные курсы комбинированной химиотерапии и всех заболевших детей стали лечить по единым стандартным протоколам. Сегодня цифры 5-летней выживаемости говорят, что от ОМЛ вылечивают около 70% детей и подростков (у специалистов принято отсчитывать 5 лет с момента постановки диагноза; если ребёнок прожил 5 лет и у него нет рецидива, он считается здоровым).
Но в то же время это значит, что около 30% заболевших детей вылечить не удаётся. Основная причина, почему их не удаётся вылечить, состоит в том, что даже когда лечение сначала проходит хорошо и даёт свои результаты, у многих детей всё равно болезнь возвращается, то есть появляются рецидивы. Такую ситуацию можно видеть примерно у одной трети всех заболевших детей. Кроме того, есть дети, у которых болезнь с самого начала не отвечает на лечение, или недостаточно хорошо отвечает на лечение (таких пациентов около 10%), то есть, как говорят врачи, они не выходят в ремиссию [ремиссия]. В этом случае специалисты говорят о неэффективности терапии.
Прогноз для каждого конкретного ребёнка зависит в первую очередь от того, какой генетический подтип ОМЛ у него нашли и как болезнь отвечает на лечение. Если у ребёнка нашли раковые клетки с благоприятными для прогноза характеристиками и ответ на лечение хороший, то статистика по выживаемости показывает 90%. Если у ребёнка находят неблагоприятные прогностические факторы, то по статистике шансы на излечение составляют менее 70%, даже если эти дети получают более интенсивное лечение. Вероятность рецидива у детей с острым промиелоцитарным лейкозом (сокращённо APL), первичные пациенты, является очень низкой. Поэтому у них цифры 10-летней выживаемости выше 90% и таким образом они имеют лучший прогноз, чем дети с другими формами ОМЛ.
Если наступает рецидив, то шансы вылечиться принципиально ниже, чем у детей без рецидива. Шансы снижаются ещё больше, если рецидив наступает очень рано. "Очень рано" означает, что с того момента, когда ребёнок вышел в первую ремиссию и до момента, когда наступил рецидив, прошло менее одного года. Это же относится и к тем детям, у которых с самого начала не было ответа на лечение. Тогда их можно ещё вылечить, если они получают противорецидивные курсы химиотерапии, и сразу после этого проводится трансплантация стволовых клеток. Сегодня у детей с рецидивом ОМЛ удаётся добиться хорошего результата лечения примерно у 40 % (специалисты говорят, что пятилетняя выживаемость составляет 40 %). Современные исследовательские протоколы [исследования оптимизации терапии] стремятся найти новые подходы в лечении, чтобы улучшить шансы на выздоровление в том числе и этих пациентов.
Необходимое замечание: когда мы называем проценты выздоровевших детей, это значит, что мы даём только точную статистику по этой форме рака у детей. Но никакая статистика не может предсказать, выздоровеет конкретный ребёнок, или нет. Любой лейкоз, даже если у ребёнка есть определённые благопритяные факторы, или наоборот, есть некоторые неблагоприятные факторы, может протекать абсолютно непредсказуемо.
Список использованной литературы 
- Kaatsch P, Grabow D, Spix C: German Childhood Cancer Registry - Anual Report 2018 (1980-2017). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz 2019 [URI: www.kinderkrebsregister.de]
- Creutzig U, Dworzak M, Reinhardt D: Akute myeloische Leukämie (AML) im Kindes- und Jugendalter. Leitlinie der Gesellschaft für Pädiatrische Onkologie und Hämatologie AWMF [URI: www.awmf.org]
- Creutzig U, Dworzak M, von Neuhoff N, Rasche M, Reinhardt D: [Acute Promyelocytic Leukemia: New treatment strategies with ATRA and ATO - AML-BFM-Recommendations]. Klinische Padiatrie 2018, 230: 299 [PMID: 30399642]
- Creutzig U, Reinhardt D: Akute myeloische Leukämien. in Niemeyer CH, Eggert A (Hrsg.): Pädiatrische Hämatologie und Onkologie 2018 [ISBN: 3540037020]
- Uffmann M, Rasche M, Zimmermann M, von Neuhoff C, Creutzig U, Dworzak M, Scheffers L, Hasle H, Zwaan CM, Reinhardt D, Klusmann JH: Therapy reduction in patients with Down syndrome and myeloid leukemia: the international ML-DS 2006 trial. Blood 2017 Jun 22; 129: 3314 [PMID: 28400376]
- Creutzig U, Dworzak MN, Bochennek K, Faber J, Flotho C, Graf N, Kontny U, Rossig C, Schmid I, von Stackelberg A, Mueller JE, von Neuhoff C, Reinhardt D, von Neuhoff N: First experience of the AML-Berlin-Frankfurt-Münster group in pediatric patients with standard-risk acute promyelocytic leukemia treated with arsenic trioxide and all-trans retinoid acid. Pediatric blood & cancer 2017, Epub ahead of print [PMID: 28111878]
- Arber DA, Orazi A, Hasserjian R, Thiele J, Borowitz MJ, Le Beau MM, Bloomfield CD, Cazzola M, Vardiman JW: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016 May 19; 127: 2391 [PMID: 27069254]
- Creutzig U ,Zimmermann M, Dworzak MN, Ritter J, Schellong G, Reinhardt D: Development of a curative treatment within the AML-BFM studies. Klinische Padiatrie 2013, 225 Suppl 1:S79 [PMID: 23700063]
- Rossig C, Jürgens H, Schrappe M, Moericke A, Henze G, von Stackelberg A, Reinhardt D, Burkhardt B, Woessmann W, Zimmermann M, Gadner H, Mann G, Schellong G, Mauz-Koerholz C, Dirksen U, Bielack S, Berthold F, Graf N, Rutkowski S, Calaminus G, Kaatsch P, Creutzig U: Effective childhood cancer treatment: The impact of large scale clinical trials in Germany and Austria. Pediatric blood & cancer 2013, 60: 1574 [PMID: 23737479]
- Kaspers GJ, Zimmermann M, Reinhardt D, Gibson BE, Tamminga RY, Aleinikova O, Armendariz H, Dworzak M, Ha SY, Hasle H, Hovi L, Maschan A, Bertrand Y, Leverger GG, Razzouk BI, Rizzari C, Smisek P, Smith O, Stark B, Creutzig U: Improved Outcome in Pediatric Relapsed Acute Myeloid Leukemia: Results of a Randomized Trial on Liposomal Daunorubicin by the International BFM Study Group. J Clin Oncol 2013, 31: 599 [PMID: 23319696]
- Reinhardt D, Von Neuhoff C, Sander A, Creutzig U: [Genetic Prognostic Factors in Childhood Acute Myeloid Leukemia]. Klinische Padiatrie 2012, 224: 372 [PMID: 22821298]
- Creutzig U, van den Heuvel-Eibrink MM, Gibson B, Dworzak MN, Adachi S, de Bont E, Harbott J, Hasle H, Johnston D, Kinoshita A, Lehrnbecher T, Leverger G, Mejstrikova E, Meshinchi S, Pession A, Raimondi SC, Sung L, Stary J, Zwaan CM, Kaspers GJ, Reinhardt D, AML Committee of the International BFM Study Group: Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel. Blood 2012, 120: 3187 [PMID: 22879540]
- Sander A, Zimmermann M, Dworzak M, Fleischhack G, von Neuhoff C, Reinhardt D, Kaspers GJ, Creutzig U: Consequent and intensified relapse therapy improved survival in pediatric AML: results of relapse treatment in 379 patients of three consecutive AML-BFM trials. Leukemia 2010 [PMID: 20535146]
- Niewerth D, Creutzig U, Bierings MB, Kaspers GJ: A review on allogeneic stem cell transplantation for newly diagnosed pediatric acute myeloid leukemia. Blood 2010, [PMID: 20538803]
- von Neuhoff C, Reinhardt D, Sander A, Zimmermann M, Bradtke J, Betts DR, Zemanova Z, Stary J, Bourquin JP, Haas OA, Dworzak MN, Creutzig U: Prognostic Impact of Specific Chromosomal Aberrations in a Large Group of Pediatric Patients With Acute Myeloid Leukemia Treated Uniformly According to Trial AML-BFM 98. Journal of clinical oncology 2010, 28: 2682 [PMID: 20439630]
- Zwaan MC, Reinhardt D, Hitzler J, Vyas P: Acute leukemias in children with down syndrome. Pediatric clinics of North America 2008, 55: 53 [PMID: 18242315]
- Belson M, Kingsley B, Holmes A: Risk factors for acute leukemia in children: a review. Environmental health perspectives 2007, 115: 138 [PMID: 17366834]

 ОМЛ (краткая информация) - AML (457KB)
ОМЛ (краткая информация) - AML (457KB)