zu 2: Vorsichtige Hydratation oral oder parenteral mit exakter Bilanzierung und Gewichtskontrolle. Bei hoher Blastenzahl oder Organomegalie Kalium-freie-Infusion mit ca. 3.000 ml/m²/24h wegen der Gefahr der Hyperkaliämie durch akuten Zellzerfall.
Bei ungenügender Ausscheidung Furosemid (1-10 mg/kg/24h) geben.
zu 3: z.B. Alkalisierungsinfusion mit 3 L Glucose 5% /m² KO; pro 1000 ml je 30 ml NaCl 10% und 40 ml Nabic 8,4% zusetzen; Urin-pH von 7-8 anstreben; je nach Höhe der HS ggf. harnsäuresenkende Medikamente geben (Allopurinol, Rasburicase (in diesem Fall keine Alkalisierung erforderlich)). Bei Hyperleukozytose kann eine Hyperphosphatämie auftreten. In diesem Fall Flüssigkeitszufuhr erhöhen und nicht alkalisieren (Urin-pH nicht >7,0).
zu 4: Sofern klinisch vertretbar, bei niedrigem Hb nicht sofort transfundieren, da bei Zytokriterhöhung eine Leukostase droht. Es sollte auch nicht über einen Hb von 7-8 g/dl auftransfundiert werden.
zu 5: Austauschtransfusion
zu 6: Wegen therapeutischer Konsequenzen sollte eine frühstmögliche Bestimmung des Plasminogens erfolgen. Es sollte versucht werden, das Defizit von pro- und antikoagulatorischen Faktoren (z.B. Plasminogen) durch Plasmagaben auszugleichen. Bei einer Tagesdosis von 30-50 ml/kg/KG Plasma pro 24 Stunden sollten die Substitutionen auf drei Einzelgaben pro Tag verteilt werden. Die Verabreichung von PPSB-Präparaten ist wegen der möglichen Thrombogenität in dieser labilen Gerinnungssituation zu vermeiden. Da die Veränderungen der plasmatischen Gerinnung multifaktoriell sind, sollten nicht einzelne Faktoren substituiert werden. Das individuelle Blutungsrisiko ist jeweils gegen das infektiologische Risiko beim Einsatz von Fresh-frozen-Plasma abzuwägen.
zu 7: Bei Thrombozytenwerten <20.000/µl ist die Gabe von Thrombozytenkonzentraten indiziert. Während der Austauschtransfusionen und der initialen Zytoreduktion sollten die Thrombozytenwerte über 60.000/µl gehalten werden.
zu 8: Hydroxyurea (Litalir) sofort: 20 mg/kg, dann 12-stündlich für 2 Tage und/oder Cytarabin 40 mg/m²/Tag s.c oder i.v., bei deutlich steigender Zellzahl 100 mg/m²/Tag Dauerinfusion.
Therapie
Autor: Jan-Henning Klusmann, erstellt 22.02.2004, Redaktion: Prof. Dr. med. Ursula Creutzig, Zuletzt geändert: 02.12.2013
Inhaltsverzeichnis
Therapieschema Hyperleukozytose
Chemotherapie
Bei Kindern mit einer Hyperleukozytose sollte möglichst zügig eine Blastenreduktion angestrebt werden, dieses sollte um so rascher erfolgen, wenn die o.g. Symptome bzw. Risikofaktoren aufgetreten sind. Die Schwierigkeit der Therapie liegt dabei in der Vermeidung eines Tumorlysesyndroms. Um die Blastenzahl zu reduzieren sollte gleichzeitig eine effektive aber auch schonende Chemotherapie gestartet werden. Durch Hydroxyurea (Litalir) kann eine Leukozytenreduktion von 50%-80% nach 24 bis 48 Sunden erreicht werden. Initial wird eine Dosis von 20 mg/kg verabreicht, dann 12-stündlich für 2 Tage und/oder Cytarabin 40 mg/m²/Tag s.c oder i.v. Bei deutlich steigender Zellzahl kann auf eine Dauerinfusion (100 mg/m²/Tag) umgestellt werden. Bei Patienten mit AML Typ FAB M3 und Hyperleukozytose (> 10 000/µl) sollte die Chemotherapie und die Gabe von ATRA gleichzeitig begonnen werden.
Durch Einsatz von ATRA kann das Risiko einer lebensbedrohlichen Blutung bei den akuten Promyelozytenleukämien deutlich gesenkt werden (9).
Weiterhin ist eine ausreichende Hydrierung angezeigt. Diese Maßnahme sollte bei allen Patienten mit einer Hyperleukozytose durchgeführt werden, bis eine AML spezifische Chemotherapie begonnen werden kann (2;3).
Zur Vermeidung einer Harnsäureerhöhung sollte ein Urikostatikum (z.B. Rasburicase, Allopurinol) gegeben werden oder der Urin zur besseren Löslichkeit der Säure alkalisiert werden.
Austauschtransfusion und Leukapherese
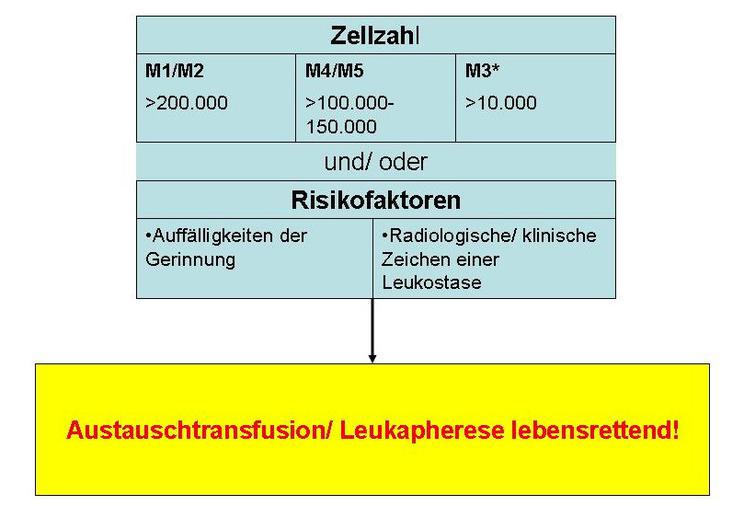
* Bisher bestehen nur bei wenigen Patienten mit M3 Erfahrungen mit der Austauschtransfusion.
Bei klinischen Symptomen einer Leukostase kann eine Austauschtransfusion oder Leukapherese lebensrettend sein. Diese Maßnahmen werden immer bei Zellzahlen über 200.000/µl und bei monozytären Leukämien bereits bei Werten >100.000-150.000/µl empfohlen. Sie sind insbesondere bei Kindern mit Auffälligkeiten der Gerinnung oder radiologisch und klinisch nachweisbaren Zeichen einer beginnenden Leukostase notwendig. Welcher der beiden Methoden Vorrang zu geben ist, konnte bisher nicht eindeutig geklärt werden (2). Aus methodischen Gründen kommt die Austauschtransfusion eher für Säuglinge und Kleinkinder in Frage, weil die benötigten Volumina einen geringeren Umfang haben und die für die Leukapherese erforderlichen intravenösen Zugänge häufig nicht verfügbar sind. Bei älteren Kindern hingegen kann eine Austauschtransfusion aufgrund des großen Austauschvolumens problematisch sein.
In einer Studie konnte bei 35 Kindern mit einer ALL, AML oder CML durch beide Methoden eine Leukozytenreduktion ohne wesentliche Komplikationen erzielt werden (5). In einer anderen Studie wurde bei Patienten mit bereits bestehenden pulmonalen, neurologischen oder renalen Symptomen, die zur Blastenreduktion eine Leukapherese erhalten hatten, eine höhere frühe Mortalität festgestellt. Auch Stemmler et al 2002 (6) stellten fest, dass asymptomatische Patienten eher von einer Leukapherese profitierten als beispielsweise Patienten mit steigenden Serumlaktatwerten als Indikator für eine beginnende Störung der Mikrozirkulation.
Bei Patienten mit einer Hyperleukozytose und gutem Allgemeinzustand kann man gegebenenfalls auf eine Austauschtransfusion oder Leukapherese verzichten. Diese Kinder sollten auf jeden Fall intensivmedizinisch überwacht werden
Tumorlysesyndromprophylaxe
Ein Tumorlysesyndrom kann bei hohem Tumorload spontan oder durch eine therapieinduzierte schnelle Lyse maligner Zellen entstehen. Eine wesentliche Gefahr des Tumorlysesyndroms ist die sich durch den Zellzerfall entwickelnde Hyperurikämie, Hyperkaliämie und die Hyperphosphatämie sowie die daraus resultierende Niereninsuffizienz. In den meisten Fällen zeigt sich ein beginnendes Tumorlysesyndrom mit Symptomen der Hyperkaliämie, wie zum Beispiel EKG-Veränderungen, bradykarden Rhythmusstörungen, Lethargie oder Muskelschwäche. Daher ist ein kontinuierliches EKG-Monitoring unter intensivmedizinischer Überwachung notwendig. Um möglichst vor Auftreten der Symptome den Beginn eines Tumorlysesyndroms zu diagnostizieren, sind bei gefährdeten Patienten engmaschige Kontrollen des Serum-Kaliumwertes erforderlich. Im weiteren Verlauf sind die Patienten durch die Freisetzung von Phospat aus den Tumorzellen gefährdet. Durch die Hyperphosphatämie kommt es in den Geweben, insbesondere in der Niere, zur Bildung von Kalziumphosphatpräzipationen. Neben der dadurch bedingten akuten Nephrokalzinose mit Niereninsuffizienz, kann es aufgrund der Hypokalzämie zu Musekelkrämpfen, Tetanie und Herzrhythmusstörungen kommen. Daher empfehlen sich ebenfalls kurzfristige Kontrollen der Phosphat- und Kalziumwerte. Eine weitere entscheidende Gefahr beim Tumorlysesyndrom ist die Hyperurikämie, die unbehandelt ebenfalls zu einer Niereninsuffizienz führt. Durch eine Alkalisierung des Urins kann diesem entgegengewirkt werden. Allopurinol oder Uratoxidase (Uricozyme®, Fasturtec®) sollten daher frühzeitig zur Verhinderung einer Hyperurikämie eingesetzt werden. Zusammenfassend sei nochmals darauf hingewiesen, das Patienten mit Hyperleukozytose, also hohem Tumorload, gefährdet sind ein Tumorlysesyndrom zu entwickeln und daher in jedem Fall engmaschige Kontrollen der Laborparameter sowie kurzfristige klinische Untersuchungen unter intensivmedizinischer Überwachung notwendig sind.
Hydrierung
Ausreichende Hydrierung mit 2-4 l/m²/Tag ist notwendig, um Nierenversagen durch Zellzerfall und Nieren/Harnwegsschäden durch Zytostatika entgegenzuwirken. !CAVE!: Auf Überwässerung achten, Elektrolyte, Bilanz und Gewicht engmaschig kontrollieren
Alkalisierung und Harnsäurereduktion
Bei Zellzerfall durch Chemotherapie entstehen Säuren, u. a. Harnsäure, die zu einer Azidose, aber primär zu Harnsäurekristallen in den Nieren führen. Deshalb wird in vielen Chemotherapieprotokollen eine Alkalisierung mit Natriumbicarbonat in der Infusionslösung durchgeführt und an Serum-pH (normal) und Urin-pH (7-8) gesteuert. Zur Harnsäurereduktion kann zusätzlich Allopurinol (Zyloric®) oder das (effektivere) Enzym Rasburicase (Fasturtec®) eingesetzt werden.
